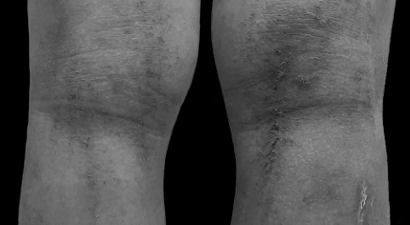
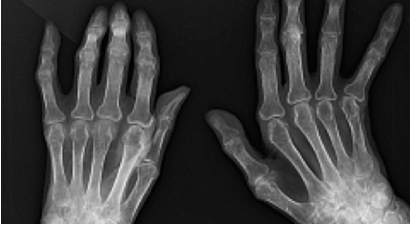
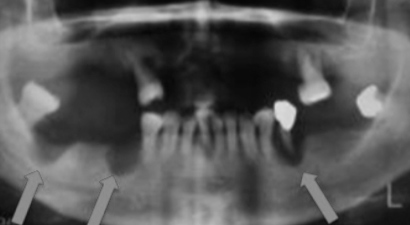
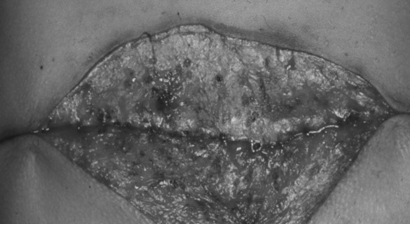
ばいようじょうせい培養上清 治療事例
ばいようじょうせい
培養上清 治療事例名古屋大学では2011年から2016年の間に、乳歯幹細胞培養上清(SHEDCM)をつかったさまざまな動物実験が行われています。
研究対象となった臓器あるいは疾患は次のようなものです。
研究対象となった臓器あるいは疾患は次のようなものです。
2012年:皮膚・骨の再生
2013年:脊髄損傷、脳梗塞、低酸素脳症
2014年:アトピー性皮膚炎
2015年:肝炎、関節リウマチ、心筋梗塞、急性腎障害、急性肺障害、アルツハイマー病、歯周病、肝炎
2016年:多発性硬化症
2013年:脊髄損傷、脳梗塞、低酸素脳症
2014年:アトピー性皮膚炎
2015年:肝炎、関節リウマチ、心筋梗塞、急性腎障害、急性肺障害、アルツハイマー病、歯周病、肝炎
2016年:多発性硬化症
同時に、SHEDCMをヒトに応用するために慎重に準備がすすめられました。
培養上清に限らず、新しい薬剤や医療機器をヒトに使用する場合になによりも重要なことは、安全性です。そこでここでは、SHEDCMの安全性を確認するために行われたさまざまな検査の詳細を紹介したいと思います。
培養上清に限らず、新しい薬剤や医療機器をヒトに使用する場合になによりも重要なことは、安全性です。そこでここでは、SHEDCMの安全性を確認するために行われたさまざまな検査の詳細を紹介したいと思います。
非感染性検査
はじめにわれわれが作製したSHEDCMに感染性がない事を証明しなくてはなりません。感染性を否定するために無菌試験、エンドトキシン試験、マイコプラズマ否定試験(PCR法、DNA染色法)の3項目、4試験が行われました。そしてこれらの検査に合格した培養上清のみをヒトに使用することにしました。
非変異原性・非アレルギー性検査
つぎにSHEDCMが細胞の突然変異を起こさない事、アレルギー反応を起こさない事を確認しました。
SHEDCMの非変異原生を確認するためにヌードマウスをもちいてAmes試験、染色体異常試験が行われました。つぎに非アレルギー性を確認するためにヒトで皮膚感作試験(LINA)、パッチテスト(24時間閉鎖)が実施され、その安全性が確認されました。
SHEDCMの非変異原生を確認するためにヌードマウスをもちいてAmes試験、染色体異常試験が行われました。つぎに非アレルギー性を確認するためにヒトで皮膚感作試験(LINA)、パッチテスト(24時間閉鎖)が実施され、その安全性が確認されました。
非毒性検査
SHEDCMに毒性がないことを確認するためにマウスとビーグル犬をつかった単回および反復静脈内投与での非臨床毒性試験を実施しました。
(単回投与:1回だけの投与、反復投与:同じ個体に何度も繰り返し投与)
マウスの急性毒性試験ではSHEDCMを20ml/kg(マウスの体重を25gとすると0.5ml)尾静脈より単回投与しました(雌雄各5匹)。対照群としてL-グルタミン含有DMEM培地を同用量投与しました(雌雄各5匹)その結果、試験群および対照群ともに、14日間の観察期間中、死亡や異常はみられませんでした。また投与後7日および14日における体重値は、試験群および対照群で差がなく、観察期間終了後の剖検においても、すべての試験動物の臓器で異常を認めませんでした。
イヌをつかった反復投与毒性試験では、ビーグル犬の前腕橈側皮静脈より1週ごとに12回20ml/kgのSHEDCMを投与しました(雌雄各2頭)。対照群としてはL-グルタミン含有DMEM培地を同量で投与しました(雌雄各1頭)。試験群および対照群ともに、健康状態を3カ月間観察するとともに、経時的に3カ月間採血を行い、血液学的、血液生化学的検査を行ないました。また最終投与後より1週後に剖検を実施しました。
その結果、3カ月の観察期間中、動物の健康状態に異常はみられず、血液学検査、血液生化学的検査においても異常は観察されませんでした。剖検の結果でも、肉眼的、組織学的に臓器の異常は認められませんでした。
(単回投与:1回だけの投与、反復投与:同じ個体に何度も繰り返し投与)
マウスの急性毒性試験ではSHEDCMを20ml/kg(マウスの体重を25gとすると0.5ml)尾静脈より単回投与しました(雌雄各5匹)。対照群としてL-グルタミン含有DMEM培地を同用量投与しました(雌雄各5匹)その結果、試験群および対照群ともに、14日間の観察期間中、死亡や異常はみられませんでした。また投与後7日および14日における体重値は、試験群および対照群で差がなく、観察期間終了後の剖検においても、すべての試験動物の臓器で異常を認めませんでした。
イヌをつかった反復投与毒性試験では、ビーグル犬の前腕橈側皮静脈より1週ごとに12回20ml/kgのSHEDCMを投与しました(雌雄各2頭)。対照群としてはL-グルタミン含有DMEM培地を同量で投与しました(雌雄各1頭)。試験群および対照群ともに、健康状態を3カ月間観察するとともに、経時的に3カ月間採血を行い、血液学的、血液生化学的検査を行ないました。また最終投与後より1週後に剖検を実施しました。
その結果、3カ月の観察期間中、動物の健康状態に異常はみられず、血液学検査、血液生化学的検査においても異常は観察されませんでした。剖検の結果でも、肉眼的、組織学的に臓器の異常は認められませんでした。
ヒトでの安全性検査
動物でのSHEDCMの安全性を確認した後で、ヒトを対象とした臨床治験・第I相試験に準じた臨床研究が行われました。
臨床治験とは新しい医薬品について安全性および有効性を検証し、政府など公的な機関の承認を得ることを目的として行われる試験です。また第I相試験とは未承認の薬剤(この場合はSHEDCM)の安全性を確認するために、主として健常男性ボランテイを対象に実施するものです。
SHEDCMのような未知の薬剤の、ヒトを対象とした臨床研究でもっとも重要な検討項目は、初回投与量の決定です。
ヒト初回投与量の決定には、動物で行われた実験結果(前臨床試験)が参考にされることが通例です。われわれは、過去に行ったマウス糖尿病モデルを使った実験のデータを初回投与量の算出に使用することにしました。糖尿病モデルが使用されたのは、われわれが行った動物実験のなかで、もっとも多くの困難で大量の培養上清を必要としたからです。つまり将来のSHEDCMをつかった培養上清治療における安全域設定のための一つの基準になりえると考えたのです。
ここで、われわれの行った実験を簡単に説明しましょう。
実験では、はじめにマウスを高カロリー飼料で飼育することでⅡ型糖尿病モデルを作成します。そしてヒト乳歯幹細胞の無血清培養上清(SHEDCM)を1回0・5ml(1日2回)を61日間点滴靜注します。マウスの体重(約25g)から計算すると投与量は40ml/kg/回に相当します。この投与により対照群(DMEM培地投与)に比べて、膵臓β細胞の機能的改善(腹腔内糖負荷試験、膵臓インスリン含量の増加)、インスリン抵抗性の改善(インスリン負荷試験)が認められました。
ヒト初回投与量の決定に際しては、まず動物実験を参考に、推定最少薬理作用量(MABEL:Minimal Anticipated Biological Effect Level)を安全係数10で除し、体重当たりのヒトの初回投与量(4ml/kg/回)の理論値を決定します。つぎに実際の初回投与量は、安全性を考慮して、1週間かけて少しずつ増量し異常のないことを確認したうえで初回投与量を決定しました。具体的なSHEDCMの投与方法は、SHEDCMを輸液と混合し、(総量100ml~500mlとして)1日2回点滴投与しました。体重60㎏のヒトの場合、19.2ml/日から開始し、下表に従い7日間で480ml/日まで増量します(漸増期)。異常がなければ、これを糖尿病の初回投与量とします。さらに入院下で、同量のSHEDCMを2週間連日投与し、異常がなければこれを維持投与量としました。漸増期は初回投与量を決めるための期間、維持期はSHEDCMの反復投与での安全性を確認するための期間といえるでしょう。
臨床治験とは新しい医薬品について安全性および有効性を検証し、政府など公的な機関の承認を得ることを目的として行われる試験です。また第I相試験とは未承認の薬剤(この場合はSHEDCM)の安全性を確認するために、主として健常男性ボランテイを対象に実施するものです。
SHEDCMのような未知の薬剤の、ヒトを対象とした臨床研究でもっとも重要な検討項目は、初回投与量の決定です。
ヒト初回投与量の決定には、動物で行われた実験結果(前臨床試験)が参考にされることが通例です。われわれは、過去に行ったマウス糖尿病モデルを使った実験のデータを初回投与量の算出に使用することにしました。糖尿病モデルが使用されたのは、われわれが行った動物実験のなかで、もっとも多くの困難で大量の培養上清を必要としたからです。つまり将来のSHEDCMをつかった培養上清治療における安全域設定のための一つの基準になりえると考えたのです。
ここで、われわれの行った実験を簡単に説明しましょう。
実験では、はじめにマウスを高カロリー飼料で飼育することでⅡ型糖尿病モデルを作成します。そしてヒト乳歯幹細胞の無血清培養上清(SHEDCM)を1回0・5ml(1日2回)を61日間点滴靜注します。マウスの体重(約25g)から計算すると投与量は40ml/kg/回に相当します。この投与により対照群(DMEM培地投与)に比べて、膵臓β細胞の機能的改善(腹腔内糖負荷試験、膵臓インスリン含量の増加)、インスリン抵抗性の改善(インスリン負荷試験)が認められました。
ヒト初回投与量の決定に際しては、まず動物実験を参考に、推定最少薬理作用量(MABEL:Minimal Anticipated Biological Effect Level)を安全係数10で除し、体重当たりのヒトの初回投与量(4ml/kg/回)の理論値を決定します。つぎに実際の初回投与量は、安全性を考慮して、1週間かけて少しずつ増量し異常のないことを確認したうえで初回投与量を決定しました。具体的なSHEDCMの投与方法は、SHEDCMを輸液と混合し、(総量100ml~500mlとして)1日2回点滴投与しました。体重60㎏のヒトの場合、19.2ml/日から開始し、下表に従い7日間で480ml/日まで増量します(漸増期)。異常がなければ、これを糖尿病の初回投与量とします。さらに入院下で、同量のSHEDCMを2週間連日投与し、異常がなければこれを維持投与量としました。漸増期は初回投与量を決めるための期間、維持期はSHEDCMの反復投与での安全性を確認するための期間といえるでしょう。
糖尿病・1回および1日投与量(体重60㎏換算)
_______________________________________
投与日 1 2 3 4 5 6 7 ・・・・・・・・・・・・21
1回投与量 9.6 19.2 48 96 144 192 240 ・・・・・・・・・・・・240ml/回
1日投与量 19.2 38.4 96 19 288 384 480 ・・・・・・・・・・・・・480ml/日
_______________________________________
投与日 1 2 3 4 5 6 7 ・・・・・・・・・・・・21
1回投与量 9.6 19.2 48 96 144 192 240 ・・・・・・・・・・・・240ml/回
1日投与量 19.2 38.4 96 19 288 384 480 ・・・・・・・・・・・・・480ml/日
臨床研究に参加した被験者およびその詳細情報は以下の通りです。
1.研究対象者 10名
1.研究対象者 10名
1群:健常者7名、男性、50歳~60歳
2群:臨床的にII型糖尿病と診断された患者3名、男性2名、女性1名、59歳~69歳
2群:臨床的にII型糖尿病と診断された患者3名、男性2名、女性1名、59歳~69歳
2.安全性の評価項目
2.安全性の評価項目
培養上清に起因する有害事項を認めず以下の検査項目で異常値を認めないこととしました。
評価は漸増期では毎日、維持期では投与終了後6週、12週で実施しました。
1 臨床所見
2血液学的・血液生化学的検査
3 空腹時血糖・随時血糖・HbA1c・血中インスリンレベル・血中C-peptideレベル
4 腎機能検査(クレアチニンクリアランス・尿検)
*①②④は1群、2群に実施、③は2群のみに実施しました。
評価は漸増期では毎日、維持期では投与終了後6週、12週で実施しました。
1 臨床所見
2血液学的・血液生化学的検査
3 空腹時血糖・随時血糖・HbA1c・血中インスリンレベル・血中C-peptideレベル
4 腎機能検査(クレアチニンクリアランス・尿検)
*①②④は1群、2群に実施、③は2群のみに実施しました。
3.評価結果
3.評価結果
1,2群とも漸増期また維持期でもすべての評価項目でSHEDCMの投与に起因する、全身的、臨床検査上の異常値はみとめませんでした。
一方、2群の糖尿病患者ではマーカーの平均値を治療前と12週後で比較するとHbA1cは治療前8.5であったが治療後は6.8と改善しました。HOMA-R レベルは劇的に減少し治療前49.3から治療後7.1に、さらにLOX-indexは1424から663に降下しました。
(HbA1c: 検査前1~2か月の平均血糖値、6.5が基準値でそれを低下すれば改善とされる。HOMA-R:インスリン抵抗性を示す指数、正常値は2,数値が低いほどインスリン分泌がよく保たれていることを示す。 LOX-index: 糖尿病などで生じる動脈硬化の指標で脳梗塞や心筋梗塞のリスクをしめす。値が低いほどリスクがひくい)
【結論】
SHEDCMの臨床応用にむけて、安全性を確認するために以下の検査と試験が行われました。
①非感染性検査、②非変異原性検査・非アレルギー検査、③動物での毒性検査④ヒトでの安全性検査
②③の検査を通じて、SHEDCMの非感染性、非変異原性、非毒性が確認されました。また④のヒトでの安全性検査から、SHEDCMの安全性が確認され、臨床応用での初回投与量および維持投与量として、480ml/60kg/日がえられました。
これらのSHEDCMの安全性に関する検証結果をもとに、2011年に脳梗塞、2014年にアトピー性皮膚炎、2015年にアルツハイマー病、2016年にⅡ型糖尿病と関節リウマチ、2020年に乳がん・ステージIVに対して、世界で初めての培養上清治療がおこなわれました。なお2021年に筋萎縮性軸索硬化症(ALS)、間質性肺炎、糖尿病腎症の治療が予定されています。
*①②④は1群、2群に実施、③は2群のみに実施しました。
一方、2群の糖尿病患者ではマーカーの平均値を治療前と12週後で比較するとHbA1cは治療前8.5であったが治療後は6.8と改善しました。HOMA-R レベルは劇的に減少し治療前49.3から治療後7.1に、さらにLOX-indexは1424から663に降下しました。
(HbA1c: 検査前1~2か月の平均血糖値、6.5が基準値でそれを低下すれば改善とされる。HOMA-R:インスリン抵抗性を示す指数、正常値は2,数値が低いほどインスリン分泌がよく保たれていることを示す。 LOX-index: 糖尿病などで生じる動脈硬化の指標で脳梗塞や心筋梗塞のリスクをしめす。値が低いほどリスクがひくい)
【結論】
SHEDCMの臨床応用にむけて、安全性を確認するために以下の検査と試験が行われました。
①非感染性検査、②非変異原性検査・非アレルギー検査、③動物での毒性検査④ヒトでの安全性検査
②③の検査を通じて、SHEDCMの非感染性、非変異原性、非毒性が確認されました。また④のヒトでの安全性検査から、SHEDCMの安全性が確認され、臨床応用での初回投与量および維持投与量として、480ml/60kg/日がえられました。
これらのSHEDCMの安全性に関する検証結果をもとに、2011年に脳梗塞、2014年にアトピー性皮膚炎、2015年にアルツハイマー病、2016年にⅡ型糖尿病と関節リウマチ、2020年に乳がん・ステージIVに対して、世界で初めての培養上清治療がおこなわれました。なお2021年に筋萎縮性軸索硬化症(ALS)、間質性肺炎、糖尿病腎症の治療が予定されています。
*①②④は1群、2群に実施、③は2群のみに実施しました。
4.培養上清の臨床応用
4.培養上清の臨床応用
培養上清を実際にヒトに応用した論文発表などの公式記録は、渉猟した範囲では名古屋大学のグループをのぞいてはみられません。2012年~2014年に、名古屋大学附属病院およびその関連病院において、また2015年以降は協力病院・クリニックあるいは介護施設で脳梗塞①アルツハイマー病②、アルツハイマー病③、Ⅱ型糖尿病③、歯周病④の臨床研究が行われています。
臨床研究に先立って、マウスによる単回投与試験、ビーグル犬を用いた反復投与の毒性試験などの非臨床試験が行われ、血液検査、主要臓器の組織学的検査で安全性が確認されました。ヒトに対する初回投与量は非臨床試験をもとに、推定最小薬理作用量(MABEL : Minimum Anticipated Biological Effect Level)をもとに 設定されました。ヒト安全性については治験I相試験が健常人5名に対して行われその安全性が確認されました。
臨床研究に先立って、マウスによる単回投与試験、ビーグル犬を用いた反復投与の毒性試験などの非臨床試験が行われ、血液検査、主要臓器の組織学的検査で安全性が確認されました。ヒトに対する初回投与量は非臨床試験をもとに、推定最小薬理作用量(MABEL : Minimum Anticipated Biological Effect Level)をもとに 設定されました。ヒト安全性については治験I相試験が健常人5名に対して行われその安全性が確認されました。
文 献
①Ueda,M . : Clinical application of stem cells, Keynote speech: Clinical Applications of stem cells derived conditioned medium, 26th-27th, Feb. 2016, Singapore
②Ueda,M. : Central Nerve Regeneration by MSCs. Joint Work Shop between Norway and Japan in Regenerative Medicine. 4th Jun, 2018,Tokyo
③Ueda,M.: 7th World Gene Convention. Keynote speech . The first in human of central nerve disorder treated with conditioned medium from dental pulp stem cell. 3th- 5th, Shanghai , 2016
④Katagiri,W et al. : First in human study and clinical case report of alveolar bone regeneration with the secretome from human mesenchymal stem cell. Head and Face Medicine 12:1-10, 2016
②Ueda,M. : Central Nerve Regeneration by MSCs. Joint Work Shop between Norway and Japan in Regenerative Medicine. 4th Jun, 2018,Tokyo
③Ueda,M.: 7th World Gene Convention. Keynote speech . The first in human of central nerve disorder treated with conditioned medium from dental pulp stem cell. 3th- 5th, Shanghai , 2016
④Katagiri,W et al. : First in human study and clinical case report of alveolar bone regeneration with the secretome from human mesenchymal stem cell. Head and Face Medicine 12:1-10, 2016
注釈
- ①乳歯幹細胞由来培養上清およびNK細胞培養上清は多数の難病の予防および治療に効果を示した。
- ②対象疾患は脳梗塞、アルツハイマ―病、糖尿病、肝炎、間質性肺炎、関節リウマチ、アトピー性皮膚炎、末期がんなどである。(これらの臨床成績はSAISEIKENの独自プロトコルを用いて、スマート・クリニック東京および培養上清研究会の協力で得られた成果であり、他の培養上清液およびそれらを用いた治療を支持するものではありません)
追補
「培養上清治療は再生医療等の安全性確保等に関する法律の規制対象ではない」(令和元年6月28日内閣衆質198第242号に対する答弁第242号) https://www.shugiin.go.jp/internet/itdb_shitsumon.nsf/html/shitsumon/b198242.htm
以下の臨床成績は国内外の学会あるいは国際誌に発表され高い評価を得て存続しています。(注釈①〜②)
名古屋大学の上田実名誉教授の長年にわたる研究や臨床経験により立証されたエビデンスは
SAISEIKEN独自のプロトコルにより厳格に管理・抽出された 印の培養上清液のみ有効です。
印の培養上清液のみ有効です。
培養上清治療について詳しくはお問い合わせください。
本稿では2011年以降に名古屋大学附属病院をはじめ複数の医療機関で行われた臨床データを集積した多施設共同研究の結果を紹介しました。
ただし培養上清の製造方法と投与量、投与期間などのプロトコルは可能な限り共通のものを使用しました。そしてそれらのなかで追跡調査が可能であった、認知症、糖尿病と関節リウマチについては、統計処理を行い有意差検定を試みています。
しかし厳密な意味での効果判定は、より多くの症例での対照群をもうけた二重盲検試験が必要です。
もとより基礎研究の重要性はいうまでもありません。
疾患に対する培養上清の作用機序、他臓器への影響、副作用の有無などは動物実験を通じて理解されるからです。
培養上清の臨床応用に際しては、厳格に安全性を確保し、培養上清の投与量、投与期間などのプロトコルは、経験値ではなく動物実験のデータをもとに科学的に決定されなくてはなりません。
SAISEIKENはこうした情報を集積し、より厳密なプロトコルを確立し、患者さんや医療機関のみなさまに提供いたします。
しかし厳密な意味での効果判定は、より多くの症例での対照群をもうけた二重盲検試験が必要です。
もとより基礎研究の重要性はいうまでもありません。
疾患に対する培養上清の作用機序、他臓器への影響、副作用の有無などは動物実験を通じて理解されるからです。
培養上清の臨床応用に際しては、厳格に安全性を確保し、培養上清の投与量、投与期間などのプロトコルは、経験値ではなく動物実験のデータをもとに科学的に決定されなくてはなりません。
SAISEIKENはこうした情報を集積し、より厳密なプロトコルを確立し、患者さんや医療機関のみなさまに提供いたします。