培養上清とは
1.はじめに
1.はじめに
「培養上清治療」はこれまで行われてきた「幹細胞治療」と対比される医療技術です。この二つの医療技術は、ともに幹細胞を利用した再生医療に分類されていますがその原理は根本的に異なっています。
より正確に「培養上清治療」をご理解いただくために、はじめに人体再生の歴史をふりかえり、つぎにこれまでの再生医療の成果とその限界を解説します。
最後に「培養上清治療」誕生の経緯と将来の可能性を解説します。
科学は古い技術の欠点を克服するために新しい技術が誕生する、この繰り返しで進歩してきました。人体の再生技術も例外ではありません。
人類は体に生じた不可逆的な損傷を修復するために、さまざまな技術を作り出してきました。いまではポピュラーになった臓器移植や再生医療もその原型は紀元前に遡ることができます。
そして「幹細胞治療」や「培養上清治療」もこうした先人の努力の結果として生まれたのです。
2.移植の時代
2.移植の時代
人体再生のもっとも古い形は、外傷や病気、加齢などで人体の形態・機能が失われたときに、何らかの材料でその機能・形態を補填することでした。文献によれば皮膚の移植は古代ローマやインドの時代に始まっていますし、人工材料による歯の再生はインカ時代のミイラに見ることができます。
その後、長い科学技術の発達をへて、今日みられるようなより洗練された移植技術として完成しました。
これらの移植技術はつぎの4つのタイプに分類することができます。
これらの移植技術はつぎの4つのタイプに分類することができます。
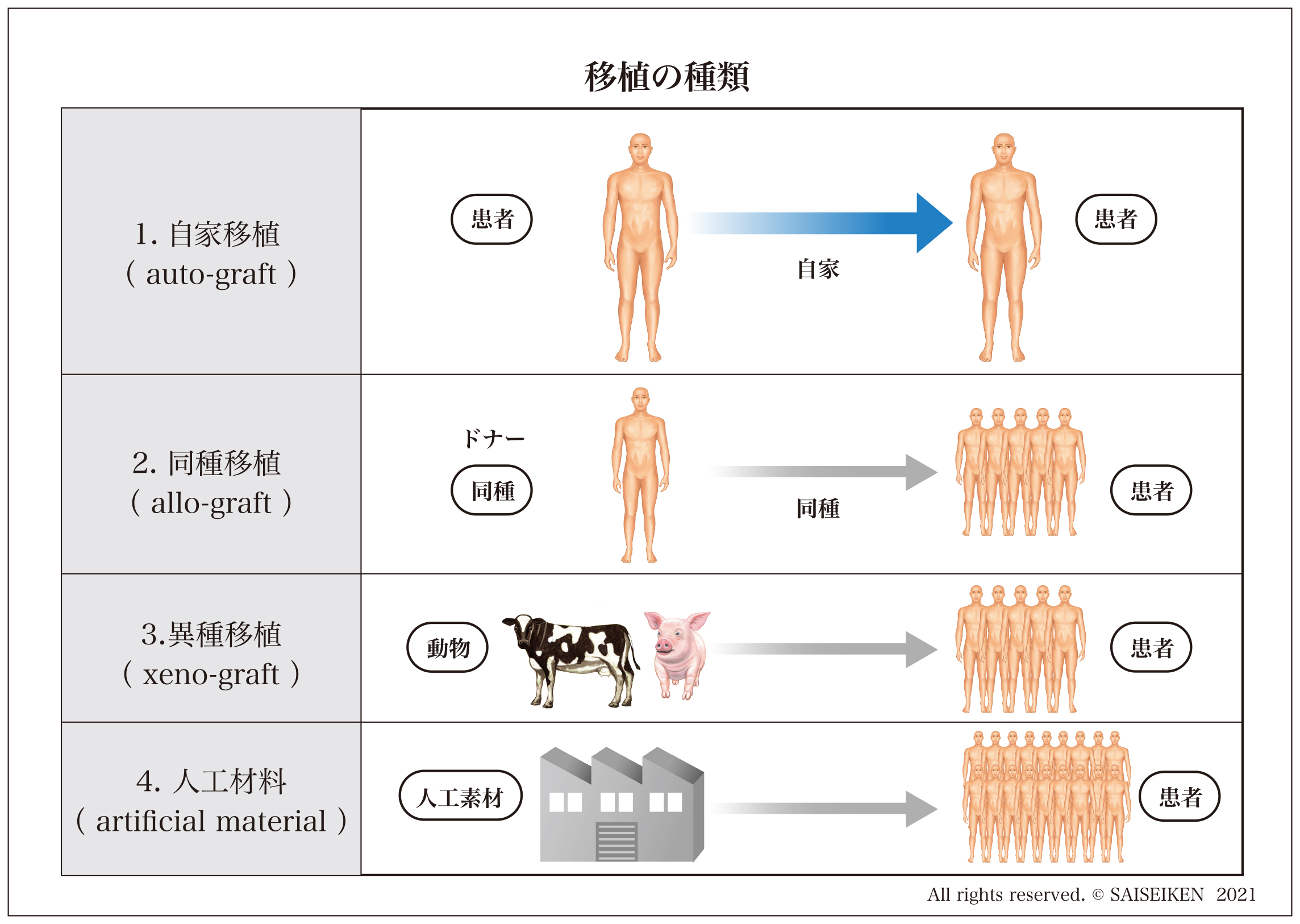
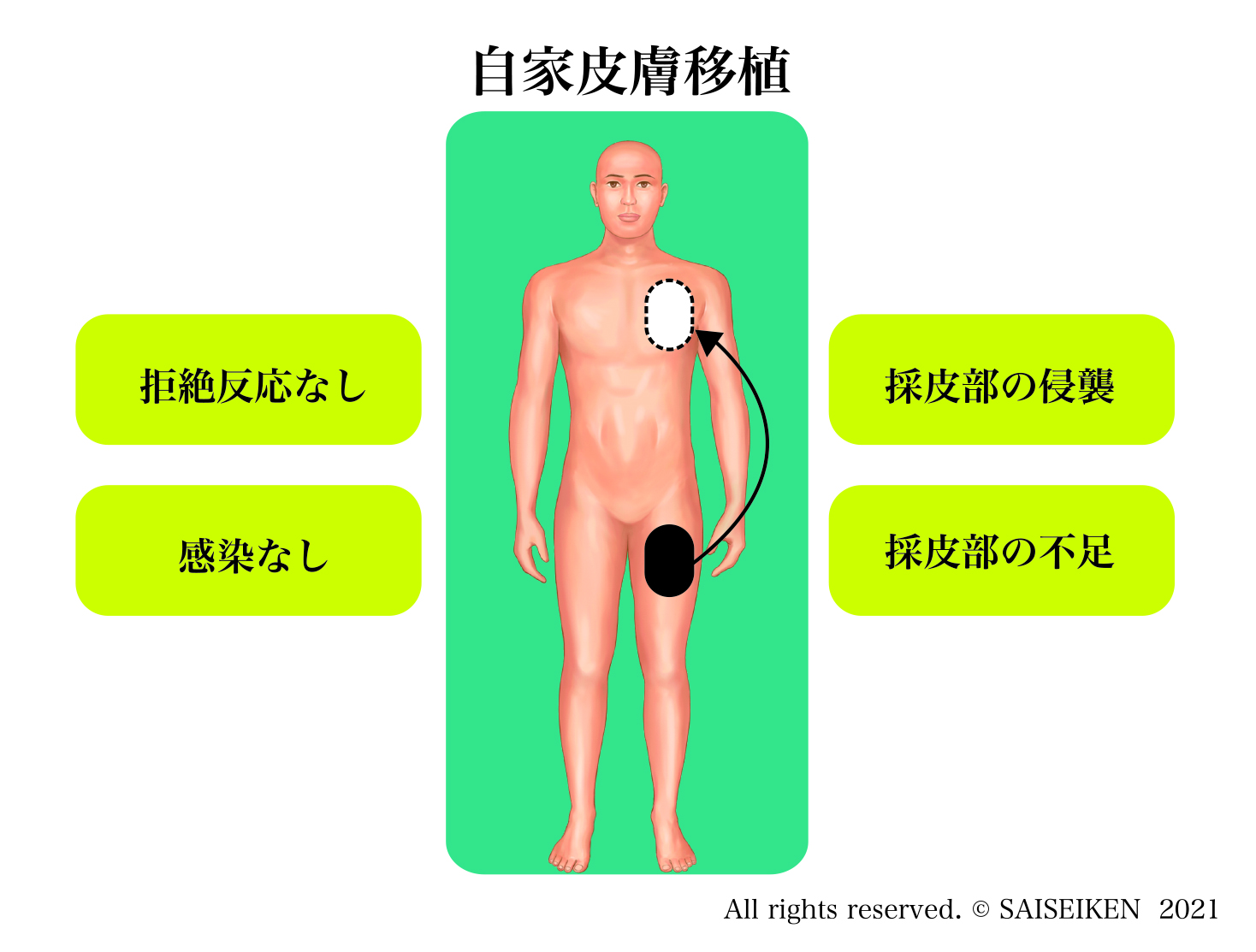
1.自家移植(auto-graft)
自分の体の一部を別の場所に生じた欠損を補充するために移植する方法。皮膚・骨の移植がその典型例です。
自分の組織なので免疫拒絶を受けませんが採取部に損傷が生じるのと、採取できる組織や臓器の量が限られるのが問題です。
自分の組織なので免疫拒絶を受けませんが採取部に損傷が生じるのと、採取できる組織や臓器の量が限られるのが問題です。
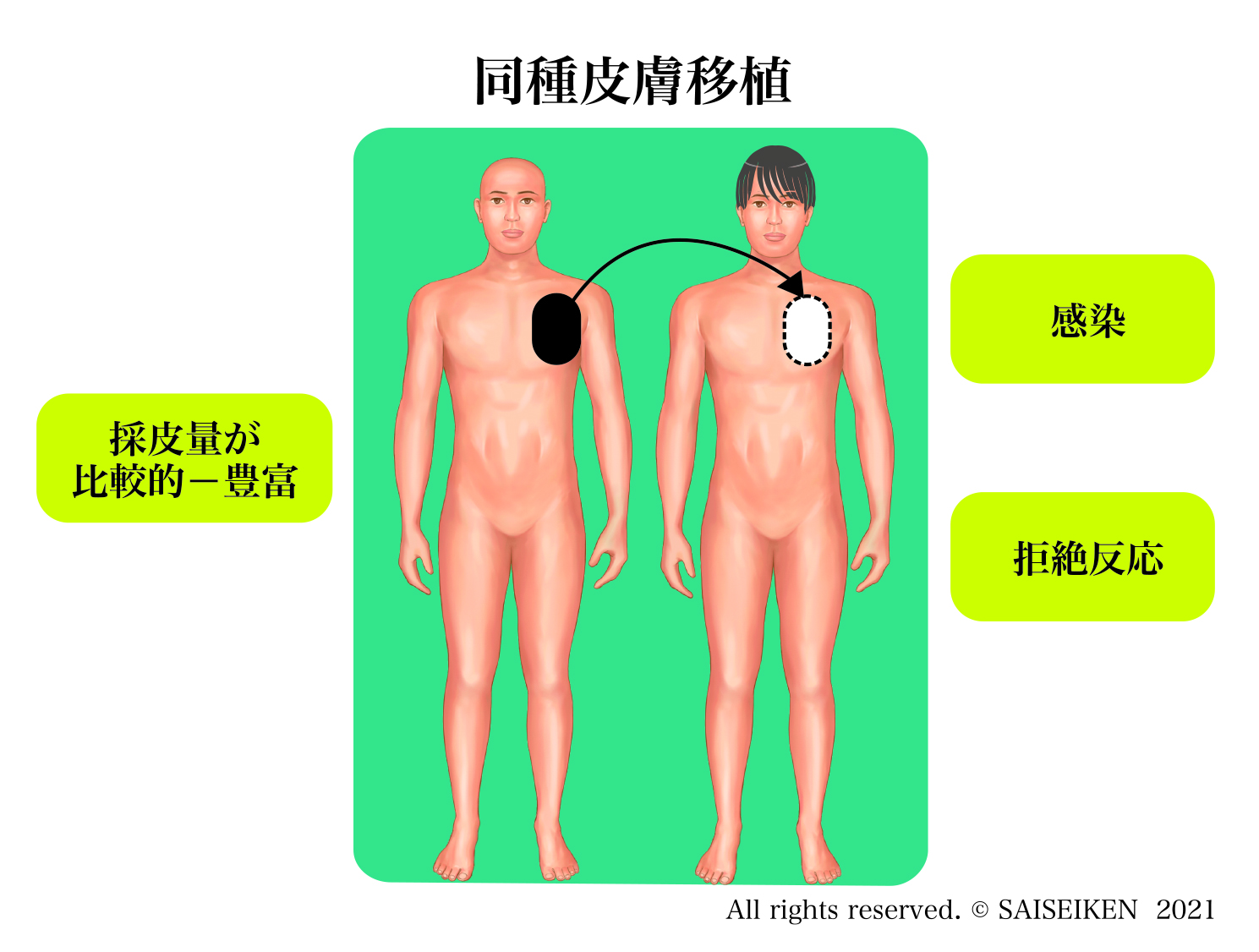
2.同種移植(allo-graft)
他人の組織・臓器を移植して人体を再生する方法。特別な処置を講じない限り免疫拒絶をうけるので生着しません。
重症熱傷に対する死体皮膚移植や免疫抑制剤の投与を前提とした死体腎移植が知られています。これらは組織・臓器丸ごとの移植ですが、細胞レベルでの同種移植としては骨髄移植があります。
同種移植の問題点はドナーを見つけるのが難しいということと免疫抑制剤の副作用です。拒絶されるのが前提で、重症の熱傷などでは一時的に傷を覆うために、死体からとった(右下の写真)皮膚を移植することもあります。
重症熱傷に対する死体皮膚移植や免疫抑制剤の投与を前提とした死体腎移植が知られています。これらは組織・臓器丸ごとの移植ですが、細胞レベルでの同種移植としては骨髄移植があります。
同種移植の問題点はドナーを見つけるのが難しいということと免疫抑制剤の副作用です。拒絶されるのが前提で、重症の熱傷などでは一時的に傷を覆うために、死体からとった(右下の写真)皮膚を移植することもあります。
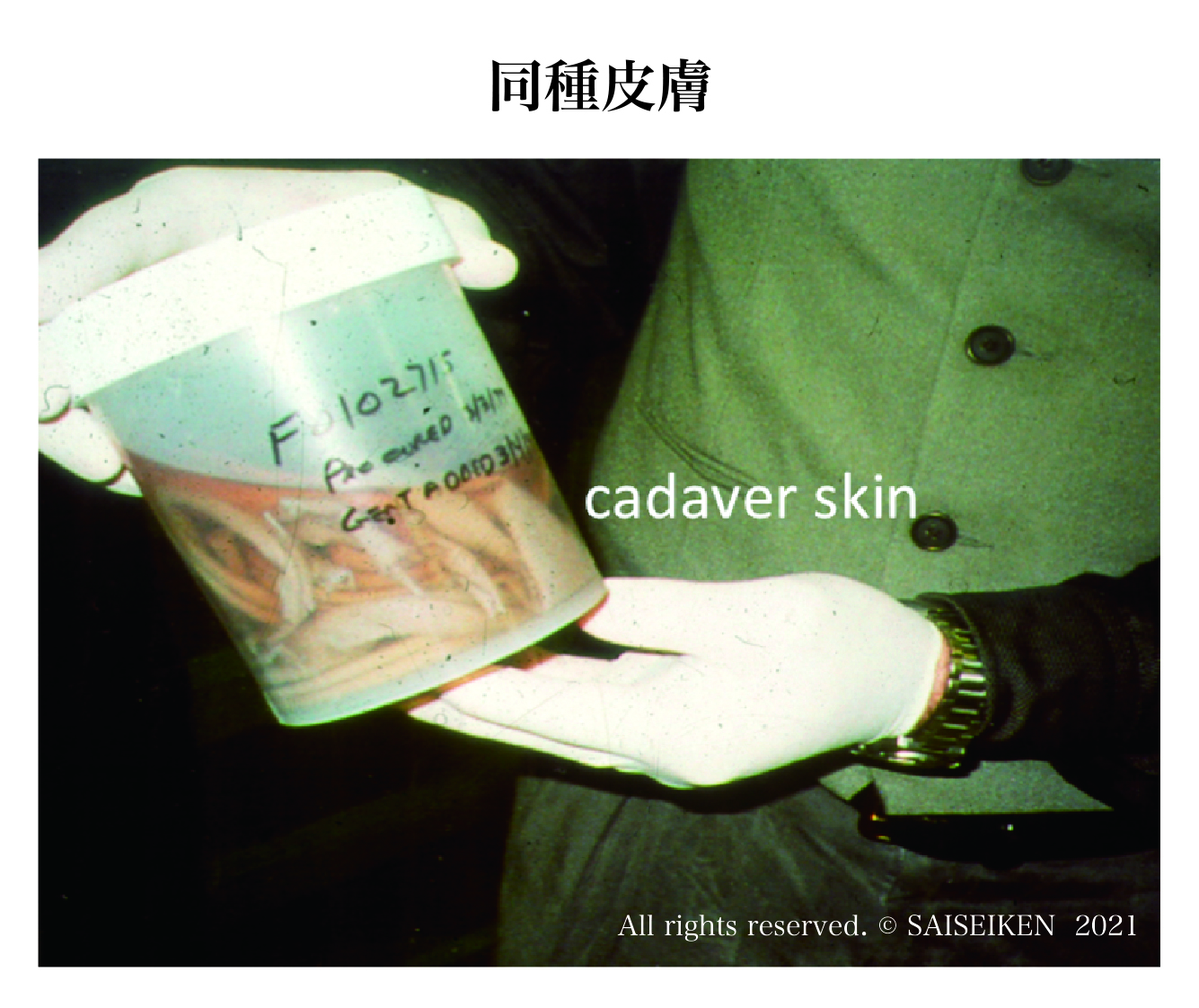
保存死体皮膚( アメリカ赤十字のスキン・バンク )
3.異種移植(xeno-graft)
ウシや豚などの動物などの組織・臓器を人に移植すること。脱細胞化処理した皮膚や骨の移植、豚の心臓弁の移植などが行われています。人獣感染の問題や激しい免疫反応のため新鮮臓器の移植はほとんど行われていません。
4.人工材料(artificial material)
合成した生体材料を使用する方法。アパタイト人工骨、ポリマー人工皮膚などが知られています。工場生産品であるためほぼ無尽蔵の供給が可能ですが、完全な生体組織の再生は期待できないといわれています。
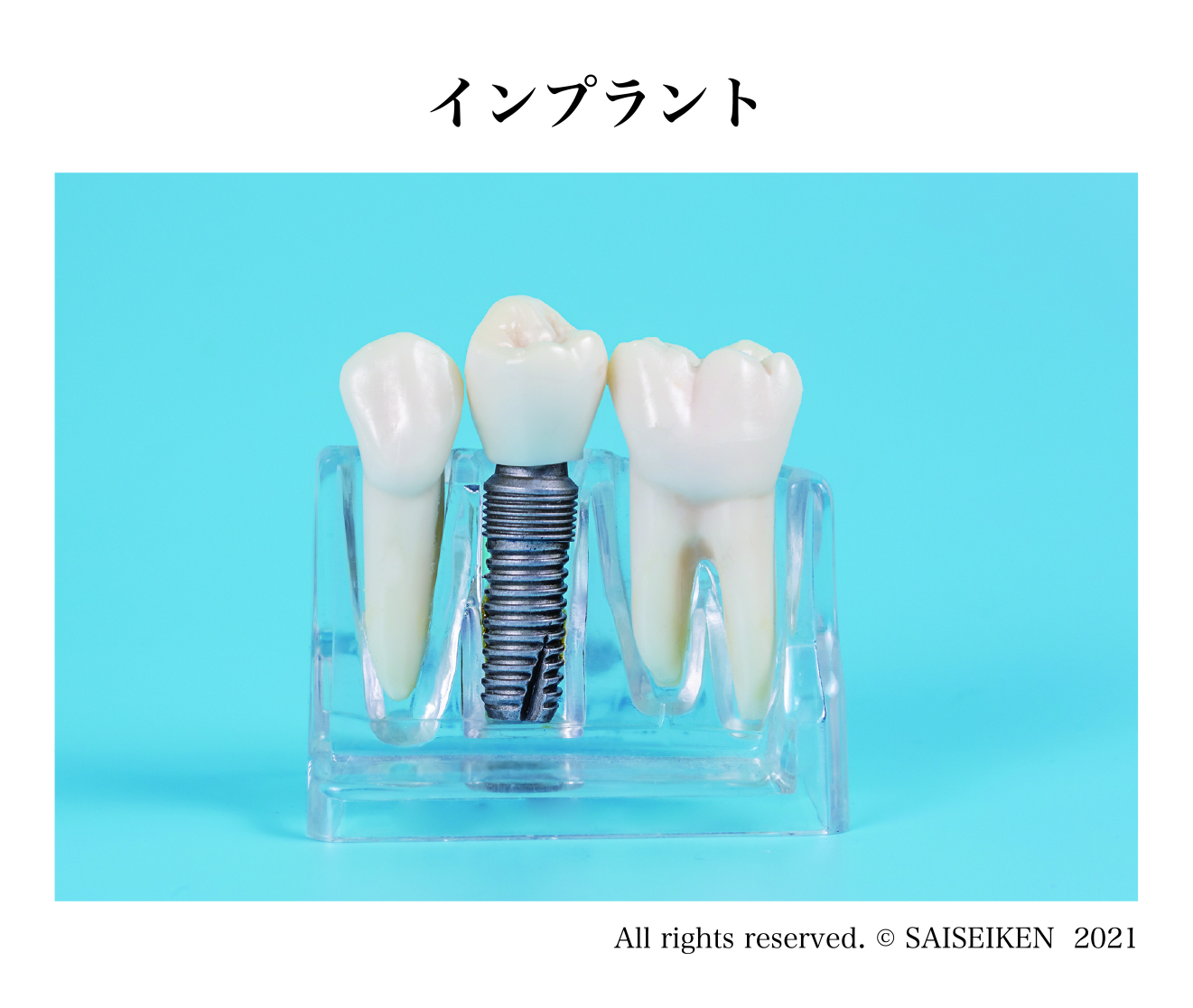
広義の人工臓器、たとえば外部動力駆動式の人工心臓、人工肺、透析装置、インプラントなどもここに分類されます。
広義の人工臓器、たとえば外部動力駆動式の人工心臓、人工肺、透析装置、インプラントなどもここに分類されます。

3.再生医療の成り立ち
3.再生医療の成り立ち
いわゆる再生医療は前章で説明した「自家組織移植」の延長線上で生まれたと考えられます。本来の自家組織移植とは、自分の体の一部を切り取って別の場所に移植することですが、採取することのできる自家組織の量は限られていますし体に新しい傷をつけることになります。この問題を、細胞だけを採取して組織を再構築することで解決しようとしたのが再生医療の出発点でした。自家細胞であれば免疫拒絶されず、培養して増やせば、いくらでも移植組織を作ることができます。
同じころ細胞レベルの移植医療は白血病の治療で行われていました。組織適合性の一致した健全な他者から造血幹細胞を採取して移植する方法(E.D. ,Thomas 1957)で、今日の幹細胞治療の原型ということができます 。
培養細胞を使って組織の構築を目指す本格的な再生医療は80年代に入って実現します。培養器のなかで皮膚や軟骨などの移植組織を作る技術です。培養組織は実際に臨床応用され一定の成果を収めます。一方、臨床現場では依然として心臓や腎臓など生体臓器の移植が行われていました。しかし移植臓器の不足が深刻化していて、細胞をつかって人工的に臓器をつくろうという機運が高まっていました。幹細胞に関する基礎的な知見を一気に臓器作りにむけて方向づけたのは臓器不足という社会的背景があったからと推察されます。しかし立体的な臓器をつくるには細胞以外に細胞の足場となる生体材料や細胞の働きを調節する信号分子が必要になり、90年代にはこれらの技術を総合してテッシュ・エンジニアリングと呼ばれる概念が生まれたのです。この概念にそって臓器の再生を目指す研究が続けられましたが臨床応用可能な臓器はできませんでした。その結果、2000年代にはいると幹細胞だけを移植して臓器の一部を再生する現在の幹細胞治療が主流となり今に至っています。
ここからは再生医療の歴史を詳しく解説してみましょう。
同じころ細胞レベルの移植医療は白血病の治療で行われていました。組織適合性の一致した健全な他者から造血幹細胞を採取して移植する方法(E.D. ,Thomas 1957)で、今日の幹細胞治療の原型ということができます 。
培養細胞を使って組織の構築を目指す本格的な再生医療は80年代に入って実現します。培養器のなかで皮膚や軟骨などの移植組織を作る技術です。培養組織は実際に臨床応用され一定の成果を収めます。一方、臨床現場では依然として心臓や腎臓など生体臓器の移植が行われていました。しかし移植臓器の不足が深刻化していて、細胞をつかって人工的に臓器をつくろうという機運が高まっていました。幹細胞に関する基礎的な知見を一気に臓器作りにむけて方向づけたのは臓器不足という社会的背景があったからと推察されます。しかし立体的な臓器をつくるには細胞以外に細胞の足場となる生体材料や細胞の働きを調節する信号分子が必要になり、90年代にはこれらの技術を総合してテッシュ・エンジニアリングと呼ばれる概念が生まれたのです。この概念にそって臓器の再生を目指す研究が続けられましたが臨床応用可能な臓器はできませんでした。その結果、2000年代にはいると幹細胞だけを移植して臓器の一部を再生する現在の幹細胞治療が主流となり今に至っています。
ここからは再生医療の歴史を詳しく解説してみましょう。
1.第一世代( 1980年〜 )黎明期
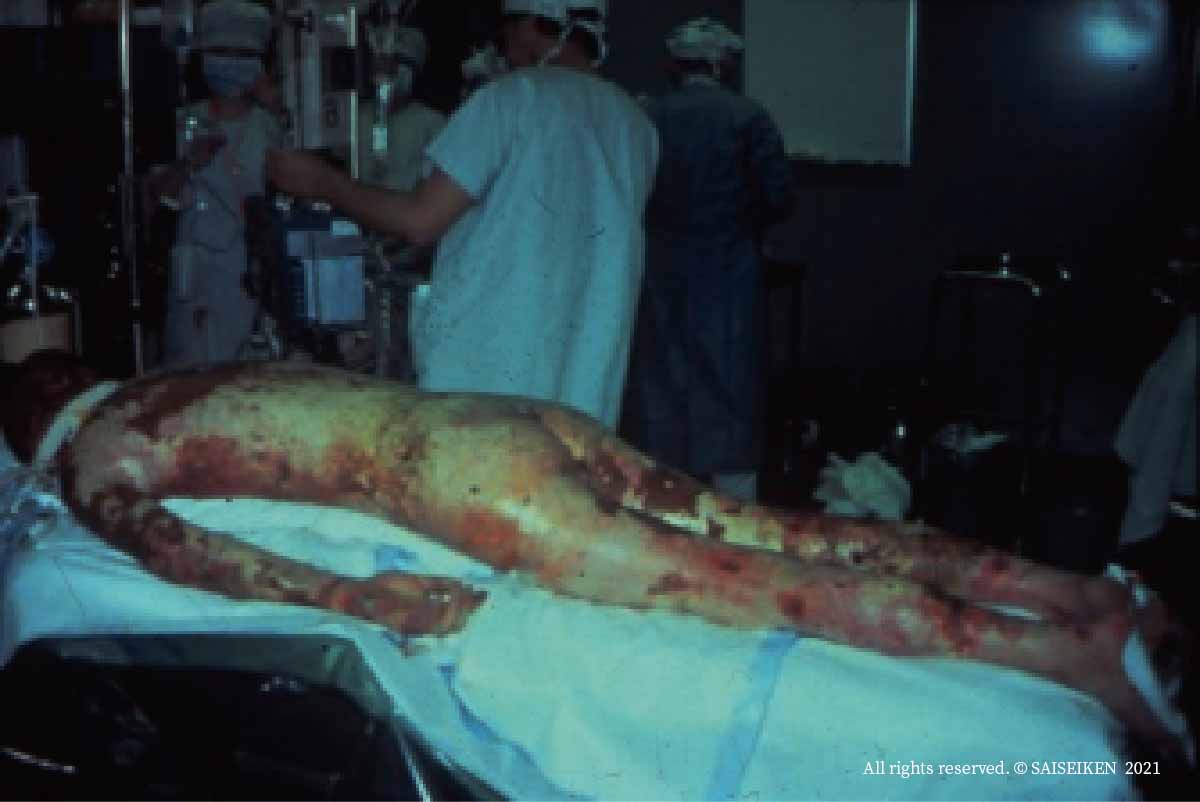
ガス爆発による全身熱傷。体表の90%以上の皮膚が損傷しています。
このような症例では、死体皮膚、動物皮膚、人工皮膚で一時的に創面をカバーして、感染と脱水を防ぎながら皮膚の自然治癒を待つほか治療法がなかったのですが、培養皮膚の進歩で救命率が高まりました。
このような症例では、死体皮膚、動物皮膚、人工皮膚で一時的に創面をカバーして、感染と脱水を防ぎながら皮膚の自然治癒を待つほか治療法がなかったのですが、培養皮膚の進歩で救命率が高まりました。
ご注意:以下に医療関係者向けの画像や映像を掲載していますので閲覧には十分ご注意ください。
画像をクリックすると、はっきり見えます。
画像をクリックすると、はっきり見えます。
皮膚表皮細胞の増殖

培養された表皮細胞を剥離して移植材料として使用する

培養表皮シートは浅い傷に適応される
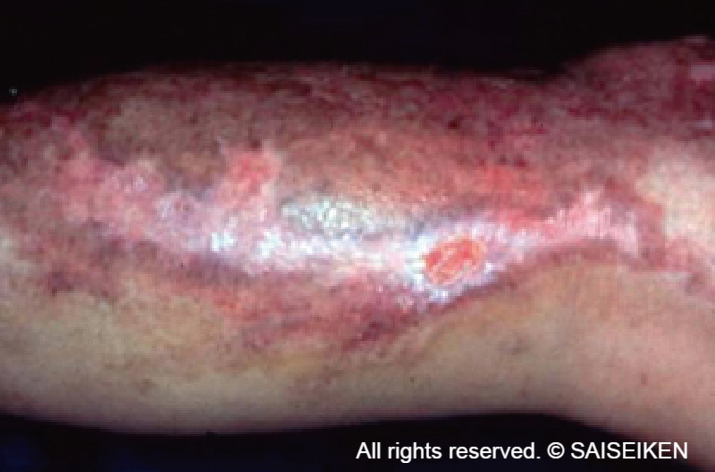
創面に移植された培養表皮は生着し皮膚を再生する
この時期の再生医療の代表例は全身熱傷に対する培養表皮①と膝軟骨欠損に対する培養軟骨②の開発です。表皮と軟骨が選ばれたのはともに単一の細胞よりなり血管網を必要としない極めて単純な構造をしているからでした。
いいかえれば培養環境下で作製できる組織としてはこれらが限界であったともいえます。
いいかえれば培養環境下で作製できる組織としてはこれらが限界であったともいえます。
2.第二世代( 1990年〜 )テイッシュ・エンジニアリング
この時代には立体構造をもった組織の作製が試みられるようになりました。
幹細胞に加えて三次元的な構造をもたせる足場材料と、血管構築を促進する生理活性物質の導入が図られました。
Tissue Engineering(ティッシュ・エンジニアリング、組織工学)という新しい概念は魅力的で多くの研究が行われました③。
幹細胞に加えて三次元的な構造をもたせる足場材料と、血管構築を促進する生理活性物質の導入が図られました。
Tissue Engineering(ティッシュ・エンジニアリング、組織工学)という新しい概念は魅力的で多くの研究が行われました③。
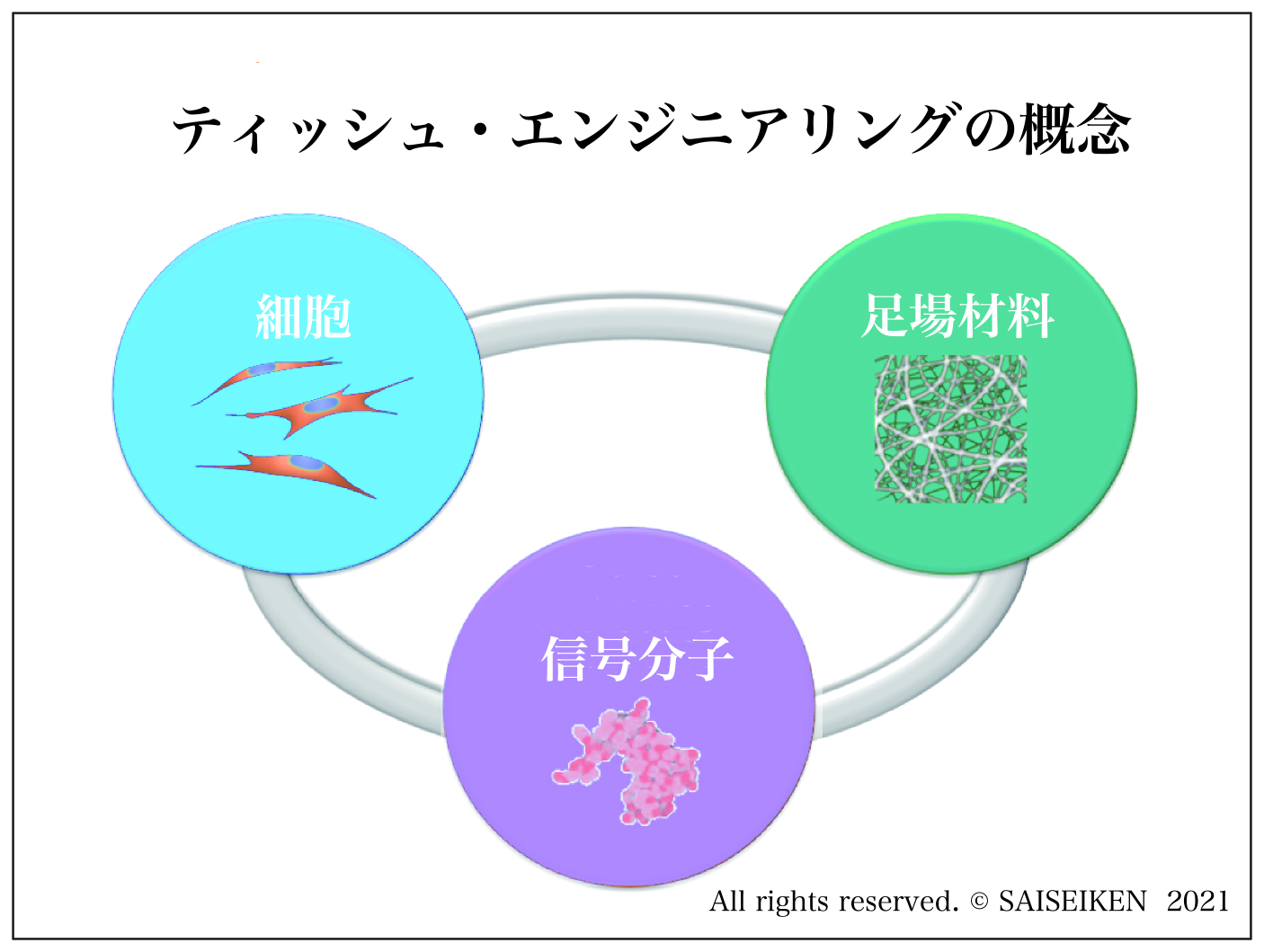
幹細胞、足場材料、信号分子を組み合わせて組織を再生する方法
テッシュ・エンジニアリングの代表例として注目を集めたのは、耳介軟骨の再生でした
ご注意:以下に医療関係者向けの画像や映像を掲載していますので閲覧には十分ご注意ください。
画像をクリックすると、はっきり見えます。
画像をクリックすると、はっきり見えます。
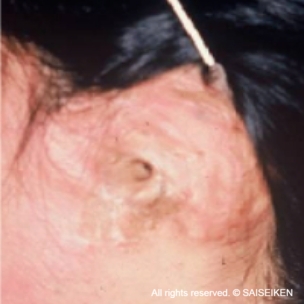
交通事故による耳介欠損
(20歳 女性)
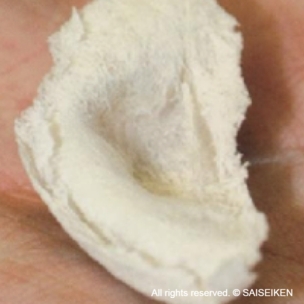
耳介の形をした人工材料

培養軟骨細胞を
人工材料に播種する
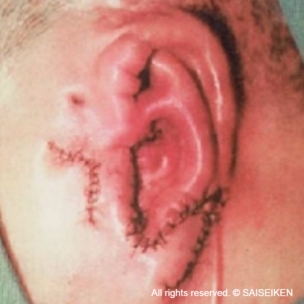
人工材料と軟骨細胞の
複合体を皮下に埋め込む
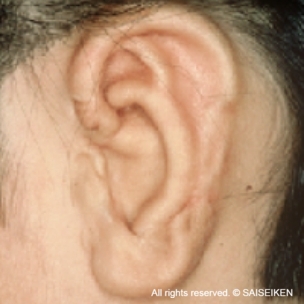
耳介軟骨が再生して
耳の形ができる
耳介軟骨以外にも、表皮と真皮組織を持つ二層性の培養皮膚が作られ④、立体構造をもつ培養骨も作られました⑤。
しかし作製できる組織量はごく少量に限られていました。
心臓や肝臓といった大量の血液を必要とする大型臓器の生体外再構築は実現しませんでした。
しかし作製できる組織量はごく少量に限られていました。
心臓や肝臓といった大量の血液を必要とする大型臓器の生体外再構築は実現しませんでした。
3.第三世代( 2000年~ )幹細胞治療
実際の移植医療の現場で求められていたのは皮膚、軟骨、骨という単純組織ではなく、中枢神経や心臓、肝臓といった大型臓器でした。
このような複雑で高度な機能をもった臓器を生体外で構築するには従来の方法では無理があったので戦略転換がなされました。
すでに実績のある骨髄移植の戦略にならって、幹細胞のみを経静脈的あるいは局所に注入して傷害された臓器を再生する方法です。
この方法であれば、既存臓器の血管系・神経系の構造がそのまま生かすことができるので、大型臓器の(部分的な)再生治療もできると考えられたのです。
このような複雑で高度な機能をもった臓器を生体外で構築するには従来の方法では無理があったので戦略転換がなされました。
すでに実績のある骨髄移植の戦略にならって、幹細胞のみを経静脈的あるいは局所に注入して傷害された臓器を再生する方法です。
この方法であれば、既存臓器の血管系・神経系の構造がそのまま生かすことができるので、大型臓器の(部分的な)再生治療もできると考えられたのです。
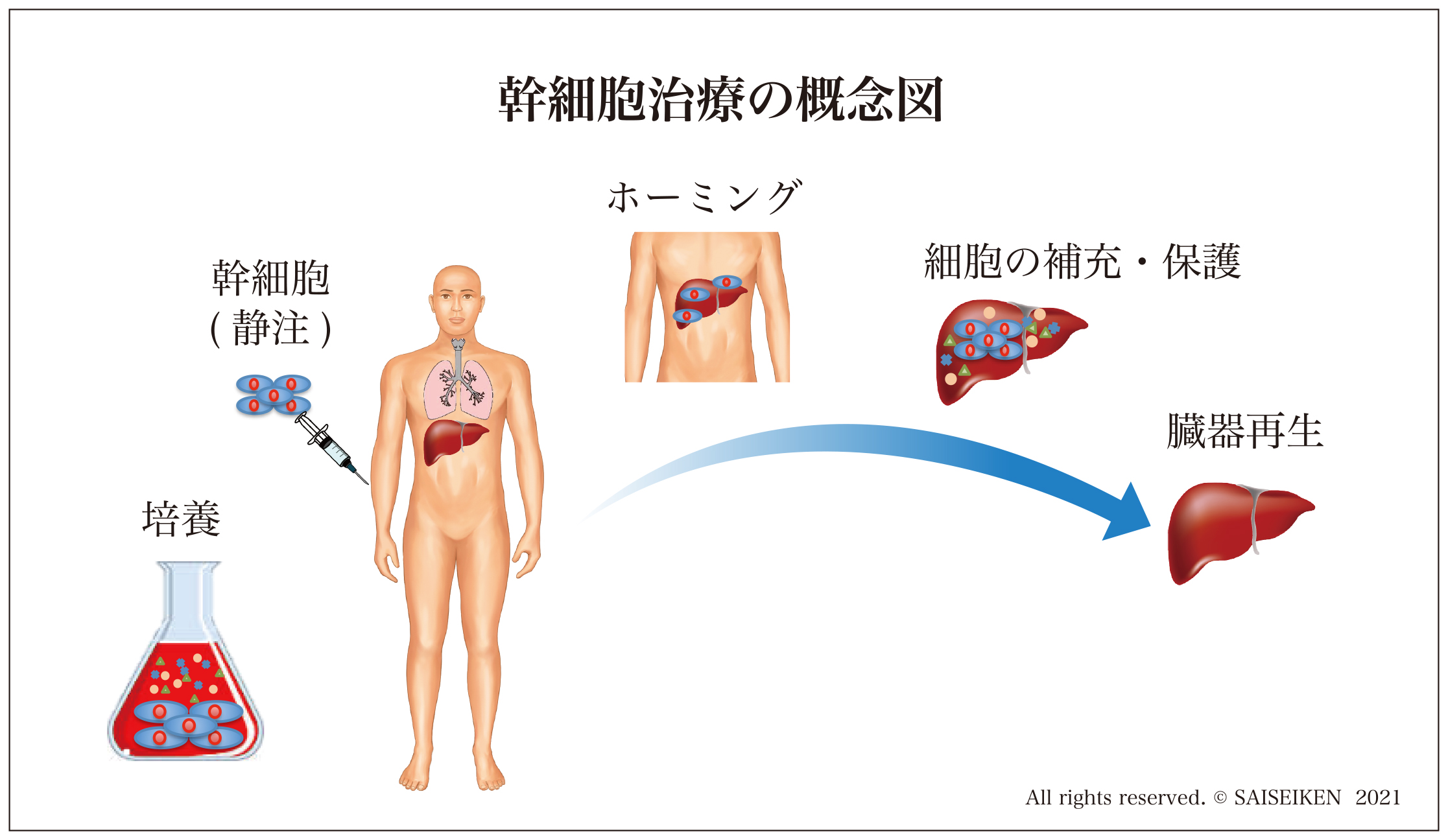
この戦略にしたがって2000年代には多くの幹細胞の移植実験が行われ、それをもとに臨床応用がはじまりました。
しかし臨床応用がすすむにつれて、さまざまな問題点が指摘されるようになりました。
たとえば幹細胞のがん化や肺栓塞のリスクです。
培養細胞に遺伝子の変異がみつかったり、点滴靜注された幹細胞が肺の毛細血管内で血栓をつくるケースが生じたのです。
静脈点滴の弱点を補うために臓器に直接、幹細胞を注入する方法(上図)もとられました。しかしこの場合は患者の負担が大きくなります。
幹細胞の培養にかかる設備費、管理費、人件費などのコストも、実際の医療現場では大きな問題になりました。
しかし臨床応用がすすむにつれて、さまざまな問題点が指摘されるようになりました。
たとえば幹細胞のがん化や肺栓塞のリスクです。
培養細胞に遺伝子の変異がみつかったり、点滴靜注された幹細胞が肺の毛細血管内で血栓をつくるケースが生じたのです。
静脈点滴の弱点を補うために臓器に直接、幹細胞を注入する方法(上図)もとられました。しかしこの場合は患者の負担が大きくなります。
幹細胞の培養にかかる設備費、管理費、人件費などのコストも、実際の医療現場では大きな問題になりました。

一方、基礎的に解明がすすめられていた臓器再生メカニズムについても疑問が生じていました。
当初は、脳梗塞であれ心筋梗塞であれ、破壊された臓器に幹細胞を補充すると、移植された幹細胞は、死んだ細胞とおきかわって臓器を再構築するともの考えられていました。この仮説に沿って脊髄⑥、心臓⑦はじめとして多くの臓器で実験が行われました。
ところが実際は違っていたのです。
ここでこれらの実験を再現してみましょう。
当初は、脳梗塞であれ心筋梗塞であれ、破壊された臓器に幹細胞を補充すると、移植された幹細胞は、死んだ細胞とおきかわって臓器を再構築するともの考えられていました。この仮説に沿って脊髄⑥、心臓⑦はじめとして多くの臓器で実験が行われました。
ところが実際は違っていたのです。
ここでこれらの実験を再現してみましょう。
(1)さまざまな病気をもったモデル動物を作製する。
(2)モデル動物に幹細胞を移植する。
(3)幹細胞は生着し実質細胞に分化して臓器を再生する。
(4)動物の病気は治る。
実験の結果は、(1)(2)(4)は予想通りでしたが(3)は予想を裏切る結果でした。
実際は、移植された幹細胞はわずか(数%)しか生着せず、短期間で消滅してしまい、実質細胞として臓器構築に参加した細胞はごく少数に過ぎませんでした。
ではどのようなメカニズムで臓器は再生したのでしょう。幹細胞の本当の役割を説明する新しい仮説が必要になります。
こうした中、登場したのがパラクライン理論(Paracrine theory )でした。臓器を再生するのは移植した幹細胞ではなく、幹細胞が産生した生理活性物質(パラクライン・ファクター:Paracrine factor )であり、生理活性物質は内在性の幹細胞を患部に誘導し、それらが臓器を再生させるという考え方です。
この解釈にたてば、移植した幹細胞がほとんど生着しないのも矛盾がなく、幹細胞の産生する生理活性物質ということになります。
移植した幹細胞の主たる役割は生理活性物質を作ることなのです。であれば幹細胞の移植は必要ではなく、生理活性物質だけを投与すれば臓器の再生ができるわけです。
幹細胞の産生する生理活性物質が臓器を再生する、この新しい仮説をもとに「培養上清治療」が生まれたのです。
実際は、移植された幹細胞はわずか(数%)しか生着せず、短期間で消滅してしまい、実質細胞として臓器構築に参加した細胞はごく少数に過ぎませんでした。
ではどのようなメカニズムで臓器は再生したのでしょう。幹細胞の本当の役割を説明する新しい仮説が必要になります。
こうした中、登場したのがパラクライン理論(Paracrine theory )でした。臓器を再生するのは移植した幹細胞ではなく、幹細胞が産生した生理活性物質(パラクライン・ファクター:Paracrine factor )であり、生理活性物質は内在性の幹細胞を患部に誘導し、それらが臓器を再生させるという考え方です。
この解釈にたてば、移植した幹細胞がほとんど生着しないのも矛盾がなく、幹細胞の産生する生理活性物質ということになります。
移植した幹細胞の主たる役割は生理活性物質を作ることなのです。であれば幹細胞の移植は必要ではなく、生理活性物質だけを投与すれば臓器の再生ができるわけです。
幹細胞の産生する生理活性物質が臓器を再生する、この新しい仮説をもとに「培養上清治療」が生まれたのです。
4.第四世代(2010~):培養上清治療
「培養上清治療」では内在性の幹細胞を活性化させ患部に誘導して損傷部を治癒させます。
この現象は、いわゆる自然治癒によくみられるものです。
たとえば足の骨が折れた場合には固定さえしておけば自然に骨は癒合します。このとき体の他の部分から幹細胞が大量に骨折部に遊走するのが観察されています。骨折部で幹細胞が増殖し大量の生理活性物質を産生します。
それらが信号となって全身の幹細胞を動員したと考えられます。
培養上清には幹細胞から放出された生理活性物質が大量に含まれています。
つまり培養上清治療は骨折のような自然治癒のプロセスを再現する医療なのです。
この現象は、いわゆる自然治癒によくみられるものです。
たとえば足の骨が折れた場合には固定さえしておけば自然に骨は癒合します。このとき体の他の部分から幹細胞が大量に骨折部に遊走するのが観察されています。骨折部で幹細胞が増殖し大量の生理活性物質を産生します。
それらが信号となって全身の幹細胞を動員したと考えられます。
培養上清には幹細胞から放出された生理活性物質が大量に含まれています。
つまり培養上清治療は骨折のような自然治癒のプロセスを再現する医療なのです。
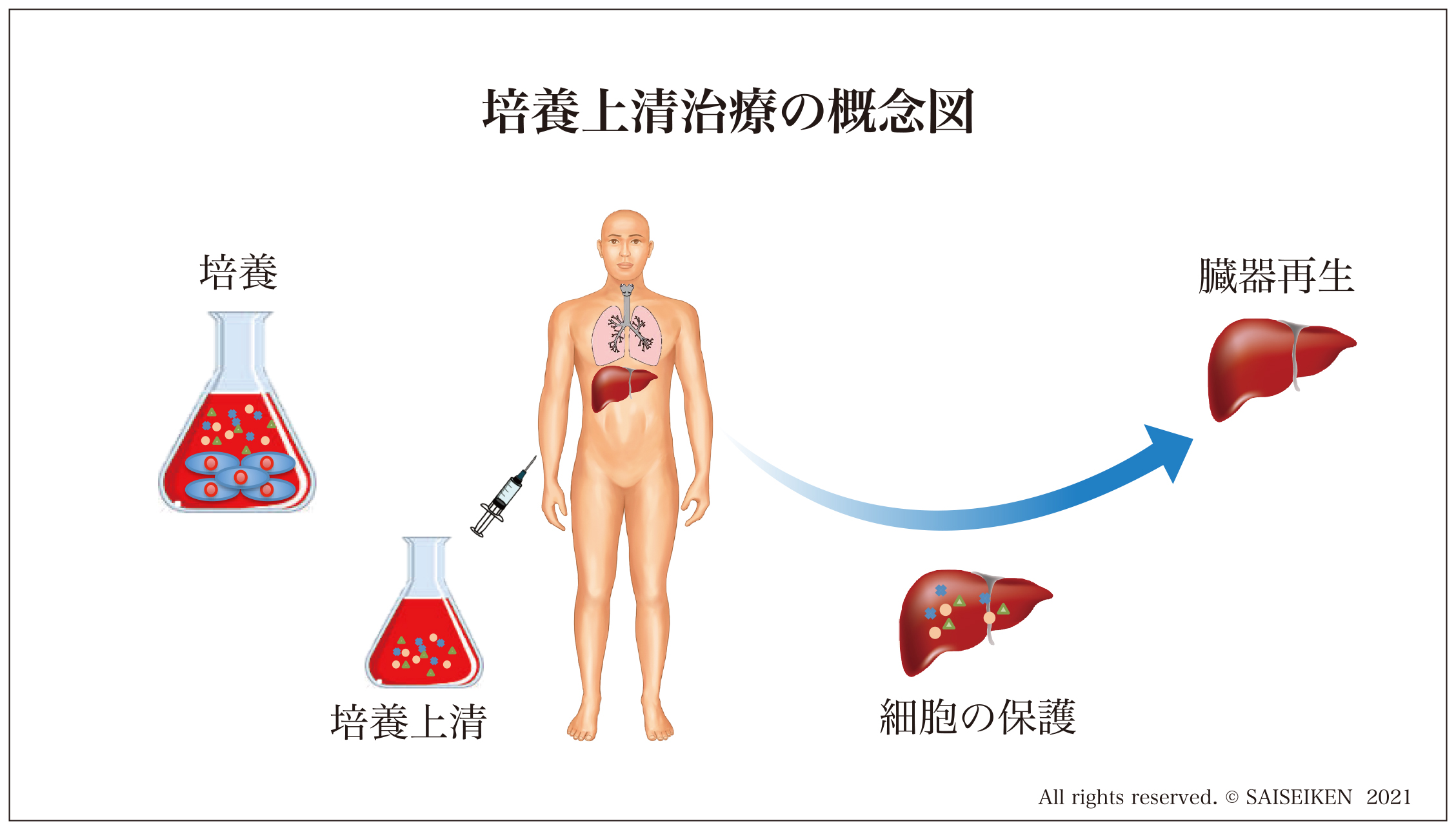
培養上清治療では培養上清の投与だけで臓器の再生を行います。
もしそれが幹細胞移植と同じ効果を得られるなら、培養上清治療には多くの利点が考えられます。
まず幹細胞の移植に伴う細胞のがん化、肺栓塞のリスクを回避できます。細胞を培養するための時間や費用、生きた細胞を保存し運搬するためのコストもなくなります。投与方法も普通の薬剤と同じように、点滴だけでなく内服も吸入もできますし、脳へは点鼻薬のように簡便に投与できることになります。
次章からはこうしたさまざまな利点をもつ培養上清治療について詳しく解説します。
もしそれが幹細胞移植と同じ効果を得られるなら、培養上清治療には多くの利点が考えられます。
まず幹細胞の移植に伴う細胞のがん化、肺栓塞のリスクを回避できます。細胞を培養するための時間や費用、生きた細胞を保存し運搬するためのコストもなくなります。投与方法も普通の薬剤と同じように、点滴だけでなく内服も吸入もできますし、脳へは点鼻薬のように簡便に投与できることになります。
次章からはこうしたさまざまな利点をもつ培養上清治療について詳しく解説します。
培養上清治療
がん化、肺栓塞のリスクなし
利点1
低いコスト(大量生産)
利点2
多彩な投与経路
(静脈点滴、点鼻投与、経肺投与、
経皮塗布、経口投与、局所注入)
利点3
文 献
①Gallico ,J.G., Green,H. et al:Permanent coverage of large burn wound with autologous cultured human epithelium, New Engl. Med. 1984, 311; 443-451,
②Britteberg,M et al: Treatment of deep cartilage defect in the knee with autologous chondrocyte transplantartion. New Engl.J.Med 1994 ,331:889-895)
③Vaccanti,C et al:Transplantation of chondrocyte utilizing a polymer-cell construct to produce tissue engineered cartilage in the sahape of human ear.: Plast. Reconstr. Surg. 100:297-302.
④Ueda,M.etal:In vitro fabrication of bioartificial mucosa for reconstruction oral mucosa.Plast.Surg.1994:128-135
⑤Yamada,Y. et al : Bone regeneration following injection of mesenchymal stem cells and fibrin glue with a biodegradable scaffold. J.Craniomaxillofacial. Sug.31:27-33,2003.
⑥Ide,C et al.: Bone marrow stromal cell transplantation for treatment of sub-acute spinal cord injury in the rat. Brai Res. 1332: 32-47, 2010,
⑦Muller-Ehmsen, J et al: Survival and development of neonatanl rat cardiomyocytes transplantation into adult myocardium. J.Mol.Cell Crdiol. 34:107-116.2002 )
