プロフィール
上田 実
代表取締役会長 / 名古屋大学名誉教授
上田 実
代表取締役会長 / 名古屋大学名誉教授 「時代はかわる」
医療が発達した現代でも、治療に対する患者さんの満足度が低く改善余地のある疾患が数多く存在します。その疾患に対する根治法がなく十分な効果が実感できない場合や、高額な治療費などで患者さんに大きな負担を強いている場合などが考えられます。このような、患者さんの側から見た治療法に対する要望が「アンメット・メディカル・ニーズ」です。したがって「アンメット・メディカル・ニーズ」の強い疾患こそ、われわれが最優先に取り組むべき対象といえるでしょう。
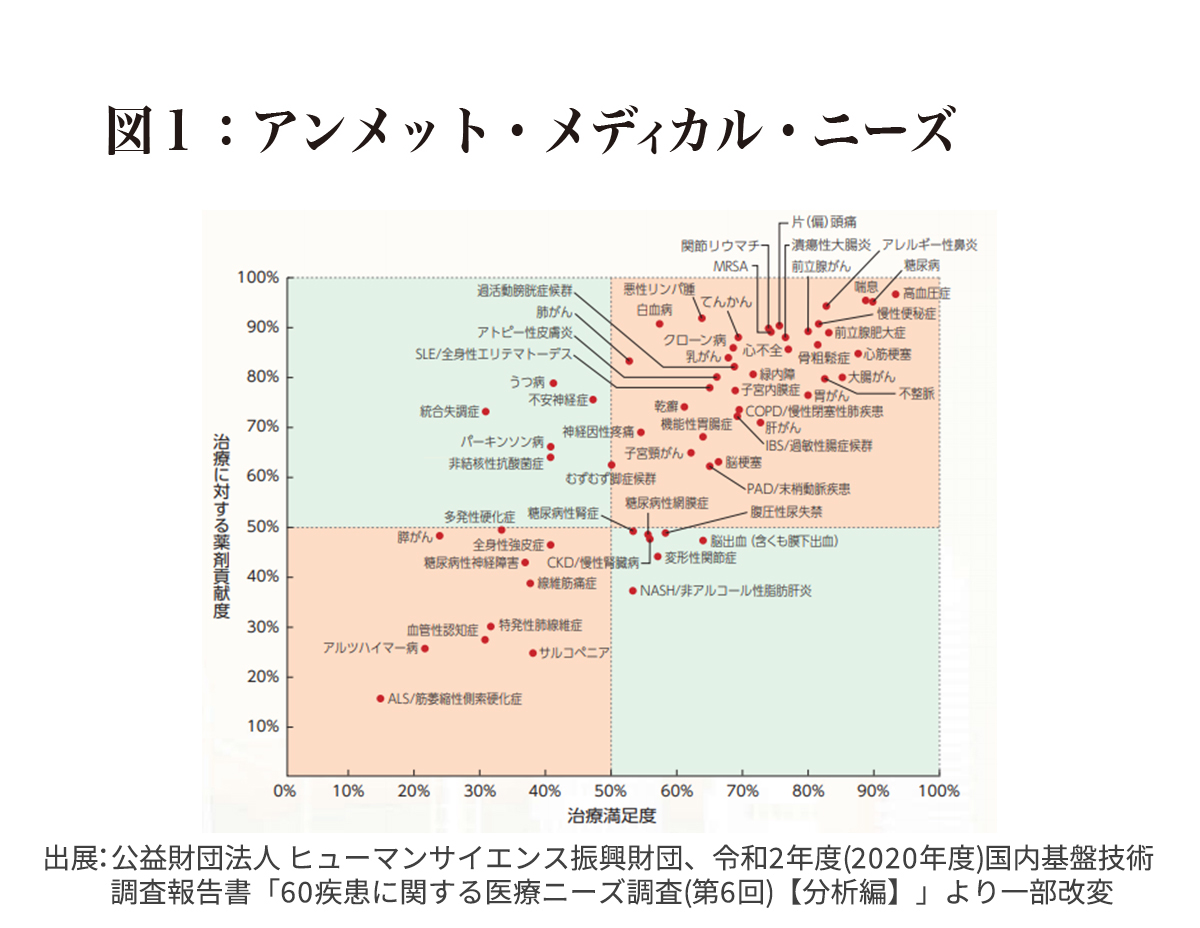
米国研究製薬工業協会によればアルツハイマー病(AD)は、「アンメット・メディカル・ニーズ」の代表例で、患者さんの満足度がもっとも低く現在の治療法がほとんど役に立っていないことを示しています(図1)。ADは患者数が多く、今後ますます増加する可能性の高い疾患で、社会的、経済的に社会を圧迫することから、その対策は世界的な緊急課題となりつつあります。
ADが増えることで生じる直接の影響は医療、介護にかかる費用の激増です。しかしそれ以上に深刻な影響は、家族(多くの場合女性や若者)がAD患者さんの介護を理由に就労を断念してしまうことです。このことは、個人にとっては人生の挫折を意味し、社会的には労働人口の不足に直結し、やがてわが国の経済成長を阻害してしまうでしょう。反対にADの治療法が見つけられたら患者さん個人の健康を回復するという医学上の成果だけにとどまらず、労働人口や労働生産
性の向上といった社会的な利益につながるのです(幻冬舎・小説万能細胞・葉山夏子著)。本稿では、はじめにADのもつ社会的・経済的問題を解説し、つぎに現在のAD治療の課題とそれを打開する可能性のある「培養上清治療」について紹介したいと思います。
国際アルツハイマー病協会は、全世界における認知症(ADが7割以上を占めるので以下ADと略す)の患者数は2030年に、7,600万人、2050年には1億3500万人になると推計しています。日本におけるデータは2017年に内閣府の発表した「高齢社会白書」があります。それによれば2025年には730万人、2050年には1000万人を超え、実に65歳以上の4人に1人がADになると試算されています。
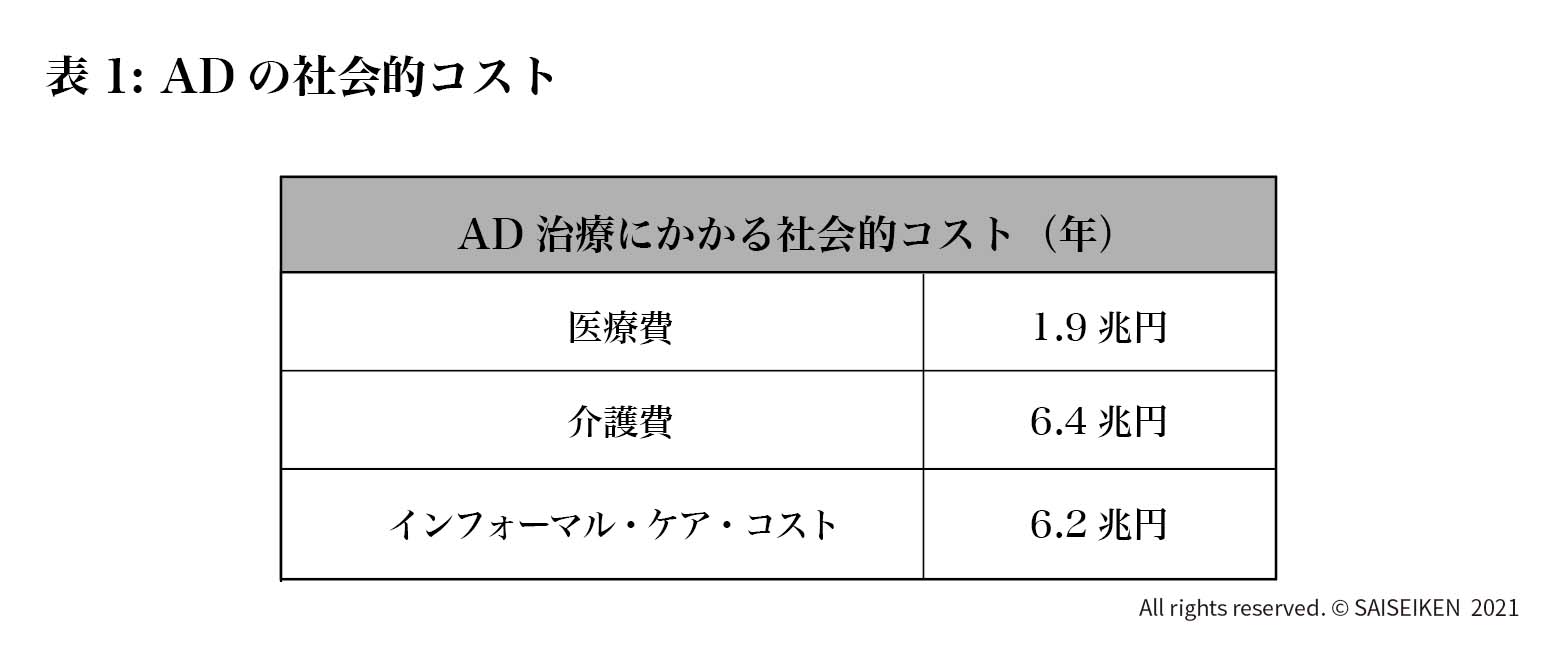
一方、ADの社会的影響の分析は遅れており、わが国では2015年に慶応大学が先駆的に行った「認知症の社会的費用の推計」があります。この推計によれば2014年時点でのADの社会的費用は年間14.5兆円とされています。費用の内訳は医療費(外来、入院)が1.9兆円、介護費(介護施設、在宅支援)が6.4兆円、インフォーマル・ケア・コスト(家族などが無償で実施するケア)が6.2兆円です(表1)。ここで注目すべきは純粋に治療にかかる費用よりも介護の費用が7倍以上にのぼるということです。つまりADは治療よりも介護が主体である特異な疾患であることを理解しなくてはなりません。
この数字を裏付けるように介護の対象となる要介護(要支援を含む)認定者数は増え続けています。2018年では655万人でしたが2040年には988万人に達すると推計されています。要介護認定者が増加すれば当然、介護にとられる人数は増加し、現在でも人不足に陥っている介護施設の職員の不足は2025年には55万人に達しますが、これらの人材確保の見通しは立っていません。かりに外国人人材を投入して人数が確保できたとしても、介護費用は要介護者数に比例しますので、慶応大学のデータをもとに算出した2040年時点での介護全体の費用は20兆円を超えてしまいます。実に国の予算の約2割をADの介護だけに使うことになるわけです。
しかし見方を変えると、もし認知症の治療が実現したら、患者さんが治療中心の生活から自立することに繋がり介護費用が減少するだけでなく、介護から解放された家族などが経済活動に復帰できることを意味します。その結果、AD患者さんのインフォーマル・ケア・コストと同じくらいの新たな富を生み出すともいえるのです。具体的には、一人の要介護者に対するインフォーマル・ケアの時間は平均29.97時間/週とされていますので、年間のインフォーマル・ケア・コストは382万円と算出できます。要介護者が一人減れば、それと同じくらいの労働生産性が生まれるのです。
このように、国全体の経済活動と深くリンクしていることは、欧米では早くから認識されており国家戦略としてAD治療薬の研究がすすめられてきました。
その結果2011年以降多くの治療候補薬が開発されています。そのなかで先頭を走っていたのが2021年6月7日に、米FDA(アメリカ食品医薬品局)に迅速承認された米バイオジェンと日本のエーザイが共同開発したMCI(軽度認知症)の「アデュカヌマブ」でした。ただこの薬は厳密には治療薬ではなく発病まえに使用する予防薬であり、承認後も検証的試験が命じられています。つまりFDAはバイオジェンが発表した治験データだけでは効果に確信が持てなかったといえるでしょう(7月12日時点で、FDAの長官代行が認可過程の適正性に調査を要請した)
「アデュカヌマブ」にかぎらずアルツハイマー病治療薬の開発は苦戦が続いています。有望な新薬候補はみあたらず、それどころか2018年以降は開発中止の発表が相次ぎ、ロッシュ(スイス)やファイザー(米)といった巨大企業ですら開発断念においこまれたのです。
このような中で期待が集まったのが幹細胞によるADの治療でした。
幹細胞治療は2000年初頭に研究がスタートし、ADをはじめほとんどの難病がその対象になっています(扶桑社・驚異の再生医療・上田実著)。現在では基礎研究の段階から臨床試験に移行しつつあり、連日のように世界から発表される論文は、幹細胞治療の有望性を伝えています。
とりわけADのように、薬物治療がほぼ絶望視されている難病に対しては、幹細胞治療が最後に残された砦なのです。幹細胞治療は、従来の薬剤のように神経毒の除去や細胞保護作用とは異なり、神経細胞そのものを補充できるという魅力的なコンセプトなので、不可逆的に神経細胞が失われるAD治療の切り札になりえるわけです。
ADの幹細胞治療でもっとも有名なのはマイアミ大学のプロジェクトです。彼らは動物実験の結果をもとに2019年から臍帯由来の同種間葉系幹細胞(hMSC)よる臨床治験を開始しています。 その治験内容を簡単に説明してみましょう。
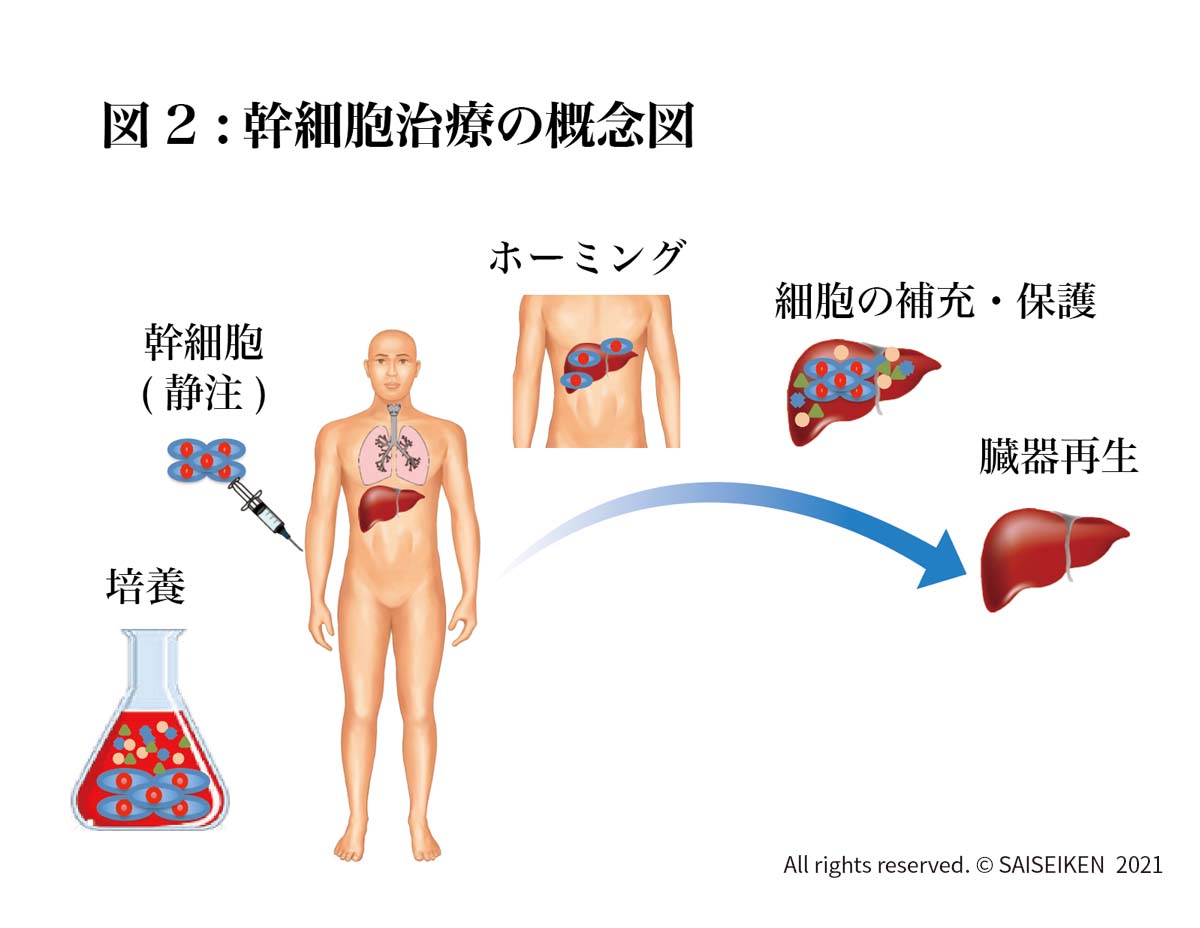
50~85歳のMMSE検査(認知、空間、言語の能力を測る検査、30点満点で24点以下が認知症)などで軽度アルツハイマー病と診断された患者にhMSC、1回1億個を4回(計4億個)点滴靜注します(図2)。観察期間は65週で、その間に血液検査、各種スコア、髄液検査、MRI、PET検査などが行われ、治療効果が評価される予定になっています。なお終了予定日は2022年9月とされているので最終結果はまだでていません。この研究は史上初めて行われるADに対する幹細胞治療なので世界中の注目を集めています。ただこの治験が成功して、幹細胞の投与によってADが改善することを証明できたとしても大きな問題が残こされています。コストの問題です。
もしマイアミ大学の幹細胞治療と同じ治療を日本で行ったとしたらどのようなことがおきるかシミュレーションしてみましょう。
現在日本では2種類の幹細胞薬MSCが承認されています。これらをADの治療に目的外使用したと考えてみましょう。
一つは急性移植片対宿主病(GVHD)の治療薬として承認された(同種)骨髄由来MSC「テムセルHS注」です(2015年9月承認)。1バックにMSCが200万個はいっていて薬価は約88.5万円です。マイアミ大のプロトコル通りならトータル4億個のMSCが必要なので、治療費は1億7700万円になります。
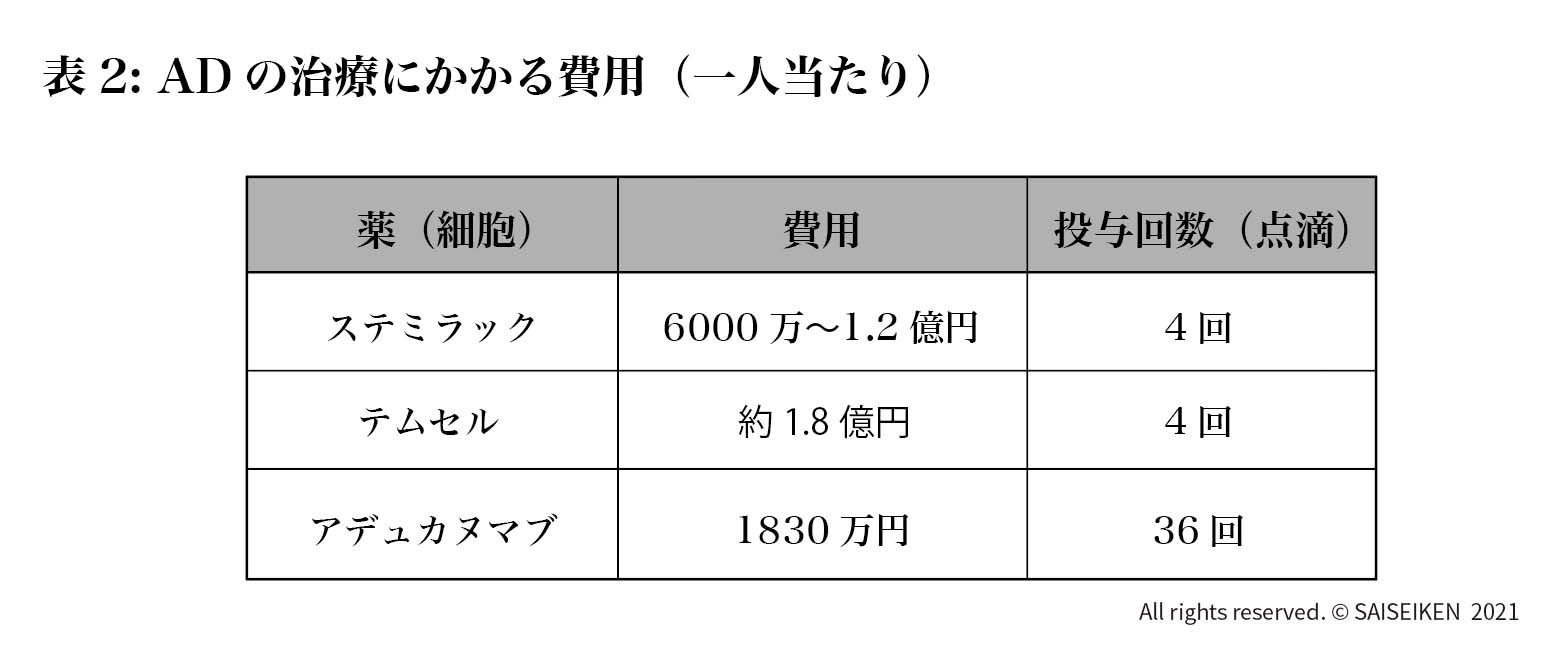
いま一つは、脊髄損傷用に承認された幹細胞薬「ステミラック注」です(2018年12月承認)。1バックに0.5~2.0億個の(自家)MSCが入っていて、薬価は1バック約1,500万円ですから治療費は3000万円(1パックに2億個の場合)から6000万円(1バッグに0.5億個の場合)になります。ただ細胞の培養にかかる費用が3000万円という情報(日経バイオテク)があったので真の原価はその倍で、企業の利益を上乗せすると実際の治療費はAD患者一人当たり1億円以上になると考えられます。いずれにしてもADの幹細胞治療には莫大な費用負担が避けられないのです(表2)。
楽観的な反論として「ADの治療ができて患者さんの健康を回復出来たら高額な在宅医療費や介護施設でのケア・コストが回避できる」というものがあります。
そんなにうまくいくのでしょうか。
日本のAD患者は10年後には730万人になります。
かりに1%の7.3万人が幹細胞治療をうけただけでも一人当たりの治療費が1億円ならば、7.3兆円にものぼります。一体、だれがどのようにしてこのコスト吸収をするのでしょう。
科学としての妥当性はともかく、幹細胞治療にはコストという致命的な問題が存在するのです。
解決法はひとつです。幹細胞の製造コストを下げることです。
治療効果が同じで、製造コストを1/100に下げられたら、1人当たりの治療費は100万円となり現在のAD医療費、14.5兆円で国内730万人のAD患者全員の幹細胞治療ができることになります。しかしコスト・ダウンができなければ、ADの幹細胞治療は「絵にかいた餅」といわざるを得ません。
幹細胞治療については有効性や安全性といった科学的な議論だけではなく、経済的な妥当性を検討すべき時期に来たといえるでしょう。
「培養上清治療」は「幹細胞治療」の進化系として生まれました。
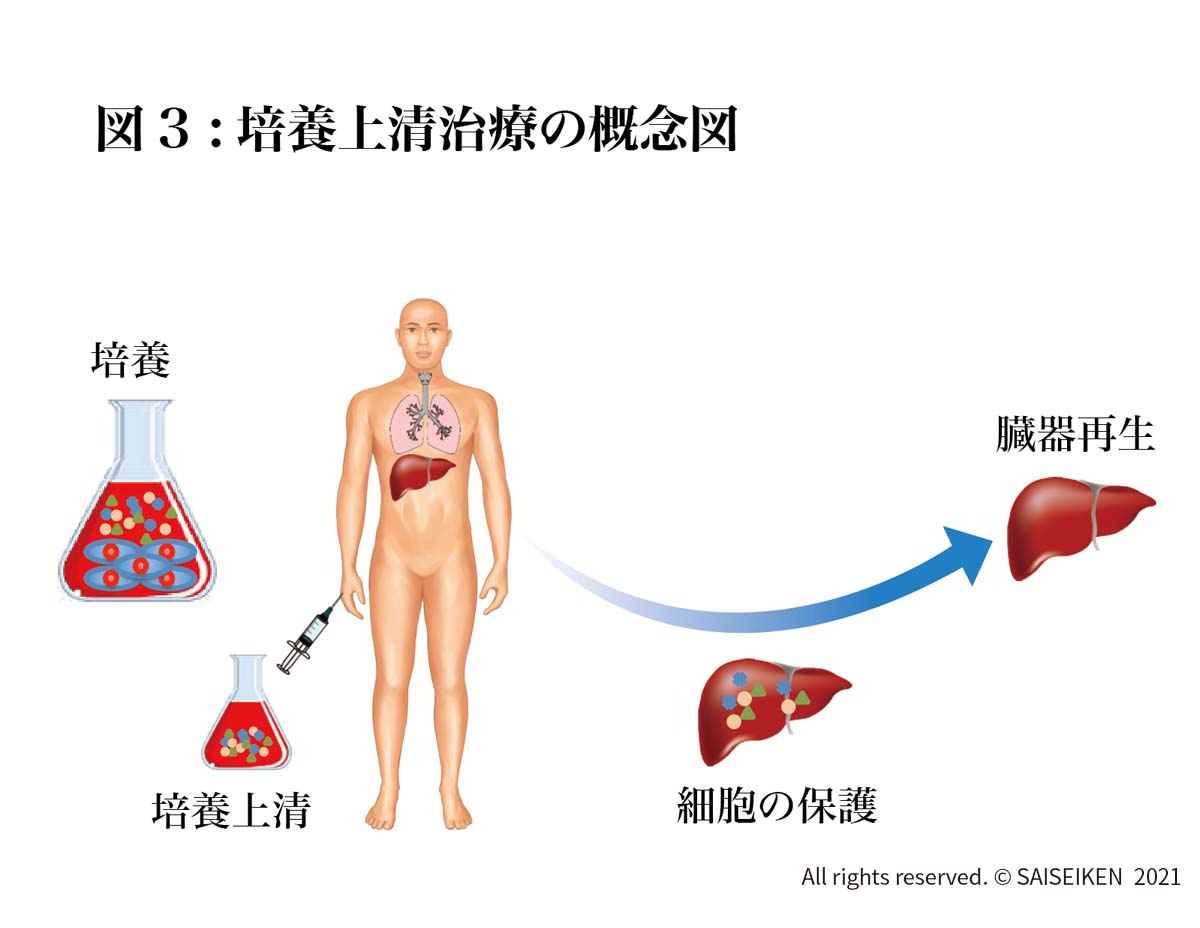
幹細胞を移植せず幹細胞の産生するタンパク質のみを点滴や点鼻薬として投与します。(図3)
「培養上清治療」の効果は「幹細胞治療」とほぼ同じです。ですが、費用を1/100に下げることが可能です。このことを分かっていただくためにこのHPを立ち上げました。
もし培養上清治療が普及してADの治療が実現したら
「介護のために退職した女性」
「介護のために進学できなかった若者」
「介護のために就職できなかった若者」
「介護疲れからの心中や殺人」
などの社会問題はなくなるかもしれません。
かりに完治できなかったとしても、頭がしっかりして介護度が少しでも軽くなったなら介護する人の負担が全く違ってきます。
ADの治療は社会問題そのものなのです。
「培養上清治療」にはADの治療を実現し、こうした社会問題を解決できる力があります。
2016年ノーベル文学賞を受賞したボブ・デイランの代表作は「The times They are a-changin’ 時代はかわる」。
このHPを通じて科学世界の「時代の変化」をみなさんとともに考えてみましょう。
「時代はかわる」
医療が発達した現代でも、治療に対する患者さんの満足度が低く改善余地のある疾患が数多く存在します。その疾患に対する根治法がなく十分な効果が実感できない場合や、高額な治療費などで患者さんに大きな負担を強いている場合などが考えられます。このような、患者さんの側から見た治療法に対する要望が「アンメット・メディカル・ニーズ」です。したがって「アンメット・メディカル・ニーズ」の強い疾患こそ、われわれが最優先に取り組むべき対象といえるでしょう。
米国研究製薬工業協会によればアルツハイマー病(AD)は、「アンメット・メディカル・ニーズ」の代表例で、患者さんの満足度がもっとも低く現在の治療法がほとんど役に立っていないことを示しています(図1)。ADは患者数が多く、今後ますます増加する可能性の高い疾患で、社会的、経済的に社会を圧迫することから、その対策は世界的な緊急課題となりつつあります。
ADが増えることで生じる直接の影響は医療、介護にかかる費用の激増です。しかしそれ以上に深刻な影響は、家族(多くの場合女性や若者)がAD患者さんの介護を理由に就労を断念してしまうことです。このことは、個人にとっては人生の挫折を意味し、社会的には労働人口の不足に直結し、やがてわが国の経済成長を阻害してしまうでしょう。反対にADの治療法が見つけられたら患者さん個人の健康を回復するという医学上の成果だけにとどまらず、労働人口や労働生産
性の向上といった社会的な利益につながるのです(幻冬舎・小説万能細胞・葉山夏子著)。本稿では、はじめにADのもつ社会的・経済的問題を解説し、つぎに現在のAD治療の課題とそれを打開する可能性のある「培養上清治療」について紹介したいと思います。
国際アルツハイマー病協会は、全世界における認知症(ADが7割以上を占めるので以下ADと略す)の患者数は2030年に、7,600万人、2050年には1億3500万人になると推計しています。日本におけるデータは2017年に内閣府の発表した「高齢社会白書」があります。それによれば2025年には730万人、2050年には1000万人を超え、実に65歳以上の4人に1人がADになると試算されています。
一方、ADの社会的影響の分析は遅れており、わが国では2015年に慶応大学が先駆的に行った「認知症の社会的費用の推計」があります。この推計によれば2014年時点でのADの社会的費用は年間14.5兆円とされています。費用の内訳は医療費(外来、入院)が1.9兆円、介護費(介護施設、在宅支援)が6.4兆円、インフォーマル・ケア・コスト(家族などが無償で実施するケア)が6.2兆円です(表1)。ここで注目すべきは純粋に治療にかかる費用よりも介護の費用が7倍以上にのぼるということです。つまりADは治療よりも介護が主体である特異な疾患であることを理解しなくてはなりません。
この数字を裏付けるように介護の対象となる要介護(要支援を含む)認定者数は増え続けています。2018年では655万人でしたが2040年には988万人に達すると推計されています。要介護認定者が増加すれば当然、介護にとられる人数は増加し、現在でも人不足に陥っている介護施設の職員の不足は2025年には55万人に達しますが、これらの人材確保の見通しは立っていません。かりに外国人人材を投入して人数が確保できたとしても、介護費用は要介護者数に比例しますので、慶応大学のデータをもとに算出した2040年時点での介護全体の費用は20兆円を超えてしまいます。実に国の予算の約2割をADの介護だけに使うことになるわけです。
しかし見方を変えると、もし認知症の治療が実現したら、患者さんが治療中心の生活から自立することに繋がり介護費用が減少するだけでなく、介護から解放された家族などが経済活動に復帰できることを意味します。その結果、AD患者さんのインフォーマル・ケア・コストと同じくらいの新たな富を生み出すともいえるのです。具体的には、一人の要介護者に対するインフォーマル・ケアの時間は平均29.97時間/週とされていますので、年間のインフォーマル・ケア・コストは382万円と算出できます。要介護者が一人減れば、それと同じくらいの労働生産性が生まれるのです。
このように、国全体の経済活動と深くリンクしていることは、欧米では早くから認識されており国家戦略としてAD治療薬の研究がすすめられてきました。
その結果2011年以降多くの治療候補薬が開発されています。そのなかで先頭を走っていたのが2021年6月7日に、米FDA(アメリカ食品医薬品局)に迅速承認された米バイオジェンと日本のエーザイが共同開発したMCI(軽度認知症)の「アデュカヌマブ」でした。ただこの薬は厳密には治療薬ではなく発病まえに使用する予防薬であり、承認後も検証的試験が命じられています。つまりFDAはバイオジェンが発表した治験データだけでは効果に確信が持てなかったといえるでしょう(7月12日時点で、FDAの長官代行が認可過程の適正性に調査を要請した)
「アデュカヌマブ」にかぎらずアルツハイマー病治療薬の開発は苦戦が続いています。有望な新薬候補はみあたらず、それどころか2018年以降は開発中止の発表が相次ぎ、ロッシュ(スイス)やファイザー(米)といった巨大企業ですら開発断念においこまれたのです。
このような中で期待が集まったのが幹細胞によるADの治療でした。
幹細胞治療は2000年初頭に研究がスタートし、ADをはじめほとんどの難病がその対象になっています(扶桑社・驚異の再生医療・上田実著)。現在では基礎研究の段階から臨床試験に移行しつつあり、連日のように世界から発表される論文は、幹細胞治療の有望性を伝えています。
とりわけADのように、薬物治療がほぼ絶望視されている難病に対しては、幹細胞治療が最後に残された砦なのです。幹細胞治療は、従来の薬剤のように神経毒の除去や細胞保護作用とは異なり、神経細胞そのものを補充できるという魅力的なコンセプトなので、不可逆的に神経細胞が失われるAD治療の切り札になりえるわけです。
ADの幹細胞治療でもっとも有名なのはマイアミ大学のプロジェクトです。彼らは動物実験の結果をもとに2019年から臍帯由来の同種間葉系幹細胞(hMSC)よる臨床治験を開始しています。 その治験内容を簡単に説明してみましょう。
50~85歳のMMSE検査(認知、空間、言語の能力を測る検査、30点満点で24点以下が認知症)などで軽度アルツハイマー病と診断された患者にhMSC、1回1億個を4回(計4億個)点滴靜注します(図2)。観察期間は65週で、その間に血液検査、各種スコア、髄液検査、MRI、PET検査などが行われ、治療効果が評価される予定になっています。なお終了予定日は2022年9月とされているので最終結果はまだでていません。この研究は史上初めて行われるADに対する幹細胞治療なので世界中の注目を集めています。ただこの治験が成功して、幹細胞の投与によってADが改善することを証明できたとしても大きな問題が残こされています。コストの問題です。
もしマイアミ大学の幹細胞治療と同じ治療を日本で行ったとしたらどのようなことがおきるかシミュレーションしてみましょう。
現在日本では2種類の幹細胞薬MSCが承認されています。これらをADの治療に目的外使用したと考えてみましょう。
一つは急性移植片対宿主病(GVHD)の治療薬として承認された(同種)骨髄由来MSC「テムセルHS注」です(2015年9月承認)。1バックにMSCが200万個はいっていて薬価は約88.5万円です。マイアミ大のプロトコル通りならトータル4億個のMSCが必要なので、治療費は1億7700万円になります。
いま一つは、脊髄損傷用に承認された幹細胞薬「ステミラック注」です(2018年12月承認)。1バックに0.5~2.0億個の(自家)MSCが入っていて、薬価は1バック約1,500万円ですから治療費は3000万円(1パックに2億個の場合)から6000万円(1バッグに0.5億個の場合)になります。ただ細胞の培養にかかる費用が3000万円という情報(日経バイオテク)があったので真の原価はその倍で、企業の利益を上乗せすると実際の治療費はAD患者一人当たり1億円以上になると考えられます。いずれにしてもADの幹細胞治療には莫大な費用負担が避けられないのです(表2)。
楽観的な反論として「ADの治療ができて患者さんの健康を回復出来たら高額な在宅医療費や介護施設でのケア・コストが回避できる」というものがあります。
そんなにうまくいくのでしょうか。
日本のAD患者は10年後には730万人になります。
かりに1%の7.3万人が幹細胞治療をうけただけでも一人当たりの治療費が1億円ならば、7.3兆円にものぼります。一体、だれがどのようにしてこのコスト吸収をするのでしょう。
科学としての妥当性はともかく、幹細胞治療にはコストという致命的な問題が存在するのです。
解決法はひとつです。幹細胞の製造コストを下げることです。
治療効果が同じで、製造コストを1/100に下げられたら、1人当たりの治療費は100万円となり現在のAD医療費、14.5兆円で国内730万人のAD患者全員の幹細胞治療ができることになります。しかしコスト・ダウンができなければ、ADの幹細胞治療は「絵にかいた餅」といわざるを得ません。
幹細胞治療については有効性や安全性といった科学的な議論だけではなく、経済的な妥当性を検討すべき時期に来たといえるでしょう。
「培養上清治療」は「幹細胞治療」の進化系として生まれました。
幹細胞を移植せず幹細胞の産生するタンパク質のみを点滴や点鼻薬として投与します。(図3)
「培養上清治療」の効果は「幹細胞治療」とほぼ同じです。ですが、費用を1/100に下げることが可能です。このことを分かっていただくためにこのHPを立ち上げました。
もし培養上清治療が普及してADの治療が実現したら
「介護のために退職した女性」
「介護のために進学できなかった若者」
「介護のために就職できなかった若者」
「介護疲れからの心中や殺人」
などの社会問題はなくなるかもしれません。
かりに完治できなかったとしても、頭がしっかりして介護度が少しでも軽くなったなら介護する人の負担が全く違ってきます。
ADの治療は社会問題そのものなのです。
「培養上清治療」にはADの治療を実現し、こうした社会問題を解決できる力があります。
2016年ノーベル文学賞を受賞したボブ・デイランの代表作は「The times They are a-changin’ 時代はかわる」。
このHPを通じて科学世界の「時代の変化」をみなさんとともに考えてみましょう。

(M.UEDA) Profile
(M.UEDA) Profile
Medical Researcher/Maxillofacial Surgeon
1949 大阪府生まれ
1978 東京医科歯科大学卒
1982 名古屋大学大学院修了
1994 名古屋大学医学部頭頚部感覚器外科教授
2003 東京大学医科学研究所客員教授
2015 名古屋大学名誉教授
1949 大阪府生まれ
1978 東京医科歯科大学卒
1982 名古屋大学大学院修了
1994 名古屋大学医学部頭頚部感覚器外科教授
2003 東京大学医科学研究所客員教授
2015 名古屋大学名誉教授
沿革
沿革
Over seas
2020 同附属病院・臨床治験アドバイザー
「間葉系幹細胞を用いた多発性硬化症の治療」
Awards
2010 名古屋大学医学部ベスト教授賞
2016 日本再生医療学会・ジョンソン&ジョンソン賞
The first in human
2011 脳梗塞
2013 糖尿病
2014 アトピー性皮膚炎
2015 アルツハイマー病
2016 変形性膝関節症/手指関節リウマチ
2021 筋萎縮性側索硬化症(ALS)/間質性肺炎/糖尿病性腎症

